CERVARIX
Laboratoire : GSK Vaccines
Après avoir envisagé son arrêt, le laboratoire GSK a décidé de maintenir la commercialisation de ce vaccin pour conserver une alternative à disposition en France. Pour rappel et d’après le calendrier des vaccinations et recommandations vaccinales en vigueur : « Toute nouvelle vaccination doit être initiée avec le vaccin Gardasil 9®. Les vaccins ne sont pas interchangeables et toute vaccination initiée avec le Cervarix® doit être menée à son terme avec le même vaccin ». Mise à jour du 23 mai 2023 : "Nature et contenu de l’emballage extérieur" et "Instructions d’utilisation de la seringue préremplie".
Description
Vaccin contre les papillomavirus humains à base de VLP (Virus Like Particles ou pseudo particules virales), bivalent (types 16 et 18), recombinant, adsorbé.
Forme et Présentation
Cervarix suspension injectable en seringue préremplie
Cervarix suspension injectable en flacon
Cervarix suspension injectable, multidose
Vaccin Papillomavirus Humain [Types 16, 18] (Recombinant, avec adjuvant, adsorbé)
Suspension trouble blanche.
Nature et contenu de l'emballage extérieur
Seringue préremplie
- 0,5 mL de suspension en seringue préremplie (verre de type I) munie d’un bouchon-piston (caoutchouc butyle) et d’un embout protecteur en caoutchouc.
Boîtes de 1 et de 10, avec ou sans aiguille(s).
Flacon
- 0,5 mL de suspension en flacon (verre de type I) pour 1 dose avec un bouchon (caoutchouc butyle).
Boîtes de 1, 10 et 100.
Flacon multidose
- 1 mL de suspension en flacon (verre de type I) pour 2 doses avec un bouchon (caoutchouc butyle).
Boîtes de 1, 10 et 100.
L’embout protecteur et le bouchon-piston en caoutchouc de la seringue préremplie ainsi que le bouchon du flacon sont fabriqués avec du caoutchouc synthétique.
Toutes les présentations peuvent ne pas être commercialisées.
Composition
Une dose (0,5 mL) contient :
1. Antigène
- Protéine L1 de Papillomavirus Humain 1 de type 16 2,3,4 : 20 microgrammes
- Protéine L1 de Papillomavirus Humain 1 de type 18 2,3,4 : 20 microgrammes
2 Avec adjuvant AS04 contenant du 3-O-desacyl-4'-monophosphoryl lipide A (MPL)³ : 50 microgrammes ;
3 Adsorbé sur hydroxyde d'aluminium hydraté Al(OH)3 : 0,5 mg Al3+ au total ;
4 Protéine L1 sous forme de pseudo particules virales non infectieuses produites par la technique de l'ADN recombinant avec un système d'expression utilisant le Baculovirus et les cellules Hi-5 Rix4446 dérivées de Trichoplusia ni.
2. Excipients
- Chlorure de sodium (NaCl) *
- Phosphate monosodique dihydraté (NaH2PO4,2 H2O)
- Eau pour préparations injectables
Indications
Cervarix est un vaccin indiqué, à partir de l’âge de 9 ans, dans la prévention des lésions ano-génitales précancéreuses (du col de l’utérus, de la vulve, du vagin et de l'anus) et des cancers du col de l’utérus et de l'anus dus à certains types oncogènes de Papillomavirus Humains (HPV). Voir les rubriques "Mises en garde spéciales et précautions d’emploi" et "Pharmacodynamie" pour des informations importantes concernant les données soutenant cette indication.
Cervarix doit être administré selon les recommandations officielles.
Posologie
Le schéma de vaccination dépend de l'âge du sujet (âge au moment de la première injection).
1. De 9 à 14 ans inclus *
- Deux doses de 0,5 mL chacune.
- La deuxième dose est administrée entre 5 et 13 mois après la première dose
2. A partir de 15 ans et plus
- Trois doses de 0,5 mL chacune à 0, 1, 6 mois **
** Si une flexibilité est nécessaire dans le schéma vaccinal, la deuxième dose peut être administrée entre 1 mois et 2,5 mois après la première dose et la troisième dose entre 5 et 12 mois après la première dose.
La nécessité d'une dose de rappel n'a pas été établie (voir rubrique "Pharmacodynamie").
Il est recommandé aux sujets qui ont reçu une première dose de Cervarix de terminer le schéma de vaccination avec Cervarix (voir rubrique "Mises en garde et précautions d'emploi").
3. Population pédiatrique (enfants âgés de moins de 9 ans)
Cervarix n'est pas recommandé chez les enfants de moins de 9 ans en raison de l'insuffisance de données de tolérance et d'immunogénicité dans cette population.
Mode d'administration
Cervarix doit être administré par voie intramusculaire dans la région deltoïdienne (voir rubriques "Mises en garde et précaution d'emploi" et "Interactions").
Cervarix ne doit en aucun cas être administré par voie intravasculaire ou intradermique. Il n’existe pas de donnée disponible sur l'administration de Cervarix par voie sous-cutanée (voir rubrique "Mises en garde et précaution d'emploi").
Si Cervarix est co-administré avec un autre vaccin injectable, les vaccins doivent toujours être administrés en des sites d'injection différents (voir rubrique "Interactions").
Contre-indications
Hypersensibilité aux substances actives ou à l'un des excipients (voir rubrique "Composition").
Mises en garde et précautions d'emploi
Comme avec tous les vaccins injectables, il est recommandé de toujours disposer d’un traitement médical approprié et d’assurer une surveillance pour le cas rare où surviendrait une réaction anaphylactique suivant l’administration du vaccin.
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l’injection. Ceci peut s’accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d’éviter des blessures en cas d’évanouissement.
L’administration de Cervarix doit être différée chez les sujets souffrant d’une maladie fébrile aiguë sévère. Cependant la présence d’une infection mineure telle qu’un rhume n’est pas une contre- indication à la vaccination.
Ce vaccin ne doit en aucun cas être administré par voie intravasculaire ou intradermique.
Il n’existe pas de donnée disponible sur l’administration de Cervarix par voie sous-cutanée.
Comme avec les autres vaccins administrés par voie intramusculaire, Cervarix doit être administré avec précaution chez les sujets présentant une thrombocytopénie ou un trouble de la coagulation, en raison du risque de saignement qui peut survenir lors de l’administration intramusculaire du vaccin chez ces sujets.
Comme pour tout vaccin, une réponse immunitaire protectrice peut ne pas être obtenue chez tous les sujets vaccinés.
Cervarix protège uniquement contre les maladies dues aux HPV de types 16 et 18 et dans une certaine mesure contre les maladies provoquées par certains autres types d’HPV oncogènes apparentés (voir rubrique "Pharmacodynamie"). Par conséquent, les mesures appropriées de précaution vis-à-vis des maladies sexuellement transmissibles doivent continuer à être prises.
Ce vaccin doit être utilisé uniquement en prévention et n’a pas d’effet sur les infections HPV en cours ni sur des maladies cliniques préexistantes dues aux HPV. Ce vaccin n’a pas démontré d’effet thérapeutique. Le vaccin n’est donc pas indiqué pour le traitement du cancer du col de l’utérus ou des néoplasies intraépithéliales cervicales (CIN). Il n’est pas non plus destiné à prévenir la progression d’autres lésions préexistantes associées aux HPV ou d’autres infections déjà présentes dues aux HPV vaccinaux ou non vaccinaux (voir rubrique "Pharmacodynamie" « Efficacité chez les femmes ayant une infection prouvée par HPV 16 ou HPV 18 à l’entrée dans l’étude. »).
La vaccination ne remplace pas le dépistage en routine du cancer du col de l’utérus. Etant donné qu’aucun vaccin n’est efficace à 100 % et que Cervarix ne protège pas contre tous les types d’HPV, ou contre les infections déjà existantes dues aux HPV, le dépistage en routine du cancer du col de l’utérus reste très important et doit suivre les recommandations locales.
La durée de la protection n’a pas encore été totalement établie. Le calendrier et la nécessité de dose(s) de rappel n’ont pas été établis.
A l’exception des sujets asymptomatiques infectés par le virus de l’immunodéficience humaine (VIH) pour lesquels des données limitées d’immunogénicité sont disponibles (voir rubrique "Pharmacodynamie"), il n’y a pas de données sur l’utilisation de Cervarix chez les sujets qui présentent une altération de la réponse immunitaire comme, par exemple, les sujets recevant un traitement immunosuppresseur. Comme avec les autres vaccins, une réponse immunitaire satisfaisante peut ne pas être obtenue chez ces sujets.
On ne dispose d’aucune donnée de tolérance, immunogénicité ou efficacité pour permettre l’interchangeabilité de Cervarix avec d’autres vaccins HPV.
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Interactions
Dans toutes les études cliniques, les sujets qui avaient reçu des immunoglobulines ou des produits dérivés de sang au cours des 3 mois précédant la première dose de vaccin ont été exclus.
1. Utilisation avec d’autres vaccins
Cervarix peut être administré simultanément avec un vaccin combiné de rappel diphtérique (d), tétanique (T) et coquelucheux (acellulaire) avec ou sans valence poliomyélitique inactivée (P) (vaccins dTca, dTca-P), sans qu'il y ait d'interférence cliniquement pertinente avec la réponse en anticorps vis-à-vis de chacun des antigènes de l'un ou l'autre vaccin. Une tendance à une plus faible moyenne géométrique des titres (MGT) en anticorps anti-HPV-16 et anti-HPV-18 a été observée lors de l'administration séquentielle du vaccin combiné dTca-P puis un mois après de Cervarix comparativement à l'administration de Cervarix seul. La pertinence clinique de cette observation n'est pas connue.
Cervarix peut également être administré de façon concomitante avec un vaccin méningococcique des sérogroupes A, C, W-135, Y conjugué à l'anatoxine tétanique (MenACYW-TT); avec un vaccin combiné contre l'hépatite A (vaccin inactivé) et contre l'hépatite B (ADNr) (Twinrix) ou avec un vaccin contre l'hépatite B (ADNr) ( Engerix B).
L’administration concomitante de Cervarix et de Twinrix (vaccin Hépatite A/Hépatite B) n’a montré aucune interférence cliniquement significative sur la réponse en anticorps vis-à-vis des antigènes HPV et hépatite A. La moyenne géométrique des concentrations en anticorps anti-HBs a été significativement plus faible après cette administration simultanée, mais la pertinence clinique de cette observation n’est pas connue étant donné que les taux de séroprotection sont restés inchangés. Le pourcentage de sujets ayant atteint une concentration en anticorps anti-HBs ≥ 10mUI/mL a été de98,3 % après vaccination concomitante et de 100 % après vaccination par Twinrix seul. Des résultats similaires ont été observés lorsque Cervarix était administré de façon concomitante avec Engerix B avec 97,9 % des sujets qui atteignaient une concentration anti-HBs ≥ 10 mUI/mL comparé à 100 % dessujets lorsqu'Engerix B était administré seul.
Si Cervarix est co-administré avec un autre vaccin injectable, les vaccins doivent toujours être administrés en des sites d'injection différents.
2. Utilisation avec des hormones contraceptives
Au cours des études cliniques, environ 60 % des femmes ayant reçu Cervarix prenaient des contraceptifs hormonaux. Il n’a pas été démontré que la contraception hormonale a un impact sur l’efficacité de Cervarix.
3. Utilisation de traitements immunosuppresseurs systémiques
Voir rubrique "Mises en garde et précaution d'emploi".
Fertilité
Il n'y a aucune données disponible sur la fertilité.
Grossesse
Aucune étude spécifique utilisant ce vaccin chez la femme enceinte n'a été réalisée. Les données recueillies chez les femmes enceintes dans le cadre de registres de grossesse, d'études épidémiologiques ou lors d'exposition accidentelle au cours des essais cliniques, sont insuffisantes pour conclure qu'il existe un risque d'issues défavorables de grossesse, y compris de fausse couche suite à une vaccination avec Cervarix.
Cependant lors du programme de développement clinique, un total de 10 476 grossesses a été déclaré incluant 5 387 femmes qui avaient reçu Cervarix. De manière générale, les proportions des issues de grossesses (par exemple nouveau-né normal, nouveau-né anormal incluant les anomalies congénitales, naissance prématurée et fausse-couche) ont été comparables, quel que soit le groupe vacciné, Cervarix ou autre.
Les études chez l'animal n'ont pas montré d'effets délétères directs ou indirects sur la fertilité, la gestation, le développement embryonnaire ou foetal, la parturition ou le développement postnatal (voir "Données de sécurité précliniques").
Par mesure de précaution, il est préférable d'éviter la vaccination par Cervarix pendant la grossesse. Les femmes enceintes ou essayant de le devenir, doivent être averties de reporter ou d'interrompre leur vaccination jusqu'à la fin de leur grossesse.
Allaitement
L'effet sur les nourrissons allaités de l'administration de Cervarix chez leurs mères n'a pas été évalué dans des études cliniques.
Cervarix ne doit être utilisé pendant l'allaitement que si les avantages potentiels l'emportent sur les risques éventuels.
Effets indésirables
1. Résumé du profil de sécurité
Dans les études cliniques, qui ont inclus des filles et des femmes âgées de 10 à 72 ans (parmi lesquelles 79,2 % étaient âgées de 10 à 25 ans au moment de l’inclusion), 16 142 sujets de sexe féminin ont reçu Cervarix tandis que 13 811 sujets féminins ont reçu le produit contrôle. Ces sujets ont été suivis pendant toute la durée de l’étude pour détecter des événements indésirables graves. Dans un sous-groupe prédéfini de sujets (Cervarix = 8 130 versus contrôle = 5 786), les évènements indésirables ont été suivis durant les 30 jours suivant chaque injection.
Au cours de deux études cliniques incluant des hommes âgés de 10 à 18 ans, 2 617 hommes ont reçu Cervarix et ont fait l’objet d’une surveillance active afin d’évaluer la tolérance du vaccin.
L’effet indésirable le plus fréquemment observé après l’administration du vaccin a été une douleur au site d’injection survenue après administration de 78 % de l’ensemble des doses. La majorité de ces effets a été d’intensité légère à modérée et de courte durée.
1.1. Liste des effets indésirables
Les effets indésirables considérés comme étant au moins possiblement liés à la vaccination ont été classés selon leur fréquence.
Les fréquences sont définies comme suit :
- très fréquent (≥1/10) ;
- fréquent (≥1/100 et < 1/10) ;
- peu fréquent (≥1/1 000 et < 1/100).
1.1.1. Observés au cours des essais cliniques
Au cours des essais cliniques, le profil de tolérance observé chez les sujets avec une infection (antérieure ou en cours) par HPV a été semblable à celui observé chez les sujets qui avaient un test ADN négatif pour les HPV oncogènes ou qui étaient séronégatifs pour les anticorps anti-HPV 16 et anti-HPV 18.
Infections et infestations
- Peu fréquent : infection des voies respiratoires supérieures.
Affections du système nerveux
- Très fréquent : céphalées.
- Peu fréquent : sensation vertigineuse.
Affections gastro-intestinales
- Fréquent : troubles gastro-intestinaux incluant nausées, vomissements, diarrhée et douleur abdominale.
Affections de la peau et du tissu sous-cutané
- Fréquent : démangeaisons/prurit, éruption cutanée, urticaire.
Affections musculo-squelettiques et systémiques
- Très fréquent : myalgie.
- Fréquent : arthralgie.
Troubles généraux et anomalies au site d'administration
- Très fréquent : réactions au site d'injection incluant douleur, rougeur, gonflement ; fatigue.
- Fréquent : fièvre (≥ 38 °C).
- Peu fréquent : autres réactions au site d'injection telle qu'induration, paresthésie locale.
1.1.2. Observés après commercialisation
Etant donné que ces événements ont été notifiés de manière spontanée, il n’est pas possible d’estimer leur fréquence de façon fiable.
Affections hématologiques et du système lymphatique
- Adénopathie.
Affections du système immunitaire
- Réactions allergiques (incluant des réactions anaphylactiques et anaphylactoïdes), œdème de Quincke.
Affections du système nerveux
- Syncope ou réaction vaso-vaguale à l’injection, parfois accompagnées de mouvements tonico-cloniques (voir rubrique "Mises en garde spéciales et précautions d'emploi").
2. Effets sur l’aptitude à conduire et à utiliser des machines
Les effets sur l’aptitude à conduire des véhicules ou à utiliser des machines n’ont pas été étudiés. Cependant, certains des effets mentionnés dans la rubrique 4.8 «Effets indésirables» peuvent affecter temporairement la capacité à conduire ou à utiliser des machines.
3. Surdosage
Aucun cas de surdosage n’a été rapporté.
4. Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet :www.signalement-sante.gouv.fr.
Pharmacodynamie
Classe pharmacothérapeutique : Vaccins, Vaccins Papillomavirus.
Code ATC : J07BM02
1. Mécanisme d'action
Cervarix est un vaccin recombinant non infectieux avec adjuvant, préparé à partir de pseudo particules virales (VLP pour Virus Like Particles) hautement purifiées de la principale protéine L1 de la capside des HPV oncogènes de types 16 et 18. Puisque les VLP ne contiennent pas d’ADN viral, elles ne peuvent ni infecter les cellules, ni se multiplier, ni provoquer de maladie. Les études chez l’animal ont montré que l’efficacité des vaccins VLP L1 résulte principalement d’une réponse immunitaire à médiation humorale.
Les HPV de types 16 et 18 sont estimés responsables d’environ 70% des cancers du col de l’utérus, 90 % des cancers anaux, 70 % des néoplasies intraépithéliales vaginales et vulvaires de haut grade liées à l’HPV et 78 % des néoplasies intraépithéliales anales de haut grade (AIN 2/3) liées à l’HPV. D’autres types d’HPV oncogènes peuvent aussi être responsables d’environ 30 % des cancers ano génitaux. Les HPV de types 45, 31 et 33 sont les 3 types d’HPV non vaccinaux les plus fréquemment identifiés dans les carcinomes épidermoïdes du col de l’utérus (12,1 %) et dans les adénocarcinomes (8,5 %).
Le terme « lésions ano génitales précancéreuses » dans la rubrique "Indications" correspond aux néoplasies intraépithéliales cervicales de haut grade (CIN2/3), aux néoplasies intraépithéliales vulvaires de haut grade (VIN2/3), aux néoplasies intraépithéliales vaginales de haut grade (VaIN2/3) et aux néoplasies intraépithéliales anales de haut grade (AIN 2/3).
2. Études cliniques
2.1. Efficacité clinique chez des femmes âgées de 15 à 25 ans
L'efficacité de Cervarix a été évaluée dans deux études cliniques de phase II et III randomisées, contrôlées, en double aveugle, qui ont inclus un total de 19 778 femmes âgées de 15 à 25 ans.
L’étude de phase II (étude 001/007) a inclus seulement des femmes qui :
- avaient un test ADN négatif pour les HPV oncogènes des types 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 et 68
- étaient séronégatives pour HPV 16 et HPV 18 et
- avaient une cytologie normale.
Le critère principal d’efficacité était l’infection incidente par HPV 16 et/ou HPV 18. L’infection persistante à 12 mois a été évaluée en tant que critère supplémentaire d’efficacité.
L’étude de phase III (étude 008) a inclus des femmes sans sélection préalable vis-à-vis de la présence d’une infection par HPV, c’est-à-dire sans tenir compte de leur cytologie et de leur statut HPV (sérologie ou test ADN) à l’inclusion.
Le critère principal d’efficacité était les CIN2+ associés à HPV 16 et/ou HPV 18 (HPV 16/18). Dans les essais cliniques, les néoplasies intraépithéliales (CIN) de grades 2 et 3 (CIN2/3) et l’adénocarcinome_in situ_ (AIS) ont été utilisés comme marqueurs de substitution du cancer du col de l’utérus.
Les critères secondaires d’efficacité ont inclus l’infection persistante à 6 et à 12 mois.
Il a également été démontré que l’infection persistante durant au moins 6 mois est un marqueur de substitution pertinent du cancer du col de l’utérus chez les femmes âgées de 15 à 25 ans.
2.2. Efficacité prophylactique contre l’infection par HPV 16/18 dans la population non infectée par des HPV oncogènes
Les femmes (N=1 113) ont été vaccinées dans l’étude 001 et évaluées au plan de l’efficacité jusqu’au mois 27. Un sous-groupe de femmes (N=776) vaccinées dans l’étude 001 a été suivi dans l’étude 007 jusqu’à 6,4 ans (environ 77 mois) après la première dose (suivi moyen de 5,9 ans). Dans l’étude 001, il y a eu cinq cas d’infection persistante à 12 mois par HPV 16/18 (4 par HPV 16 ; 1 par HPV 18) dans le groupe contrôle et un cas par HPV 16 dans le groupe vaccin. Dans l’étude 007, l’efficacité de Cervarix contre les infections persistantes à 12 mois par HPV 16/18 a été de 100 % (IC à 95 % : 80,5 ; 100). Il y a eu seize cas d’infection persistante par HPV 16 et cinq cas d’infection persistante par HPV 18, tous dans le groupe contrôle.
Dans l’étude HPV-023, les sujets issus de la cohorte brésilienne (N=437) de l’étude 001/007 ont été suivis jusqu’à 8,9 ans en moyenne (écart-type de 0,4 ans) après la première dose. A la fin de l’étude, il n’y a eu aucun cas d’infection ou de lésions histopathologiques associées à l’HPV 16 ou à l’HPV 18 dans le groupe vacciné de l’étude HPV-023. Dans le groupe placebo, il y a eu 4 cas d’infection persistante à 6 mois et un cas d’infection persistante à 12 mois. L’étude n’avait pas la puissance pour démontrer une différence entre le vaccin et le placebo pour ces critères.
2.3. Efficacité prophylactique vis-à-vis des HPV 16 et 18 chez les femmes non infectées par HPV 16 et/ou HPV 18
Dans l’étude HPV-008, les analyses principales d’efficacité ont été conduites sur la cohorte « According to Protocol » (selon protocole) (cohorte ATP : incluant les femmes ayant reçu 3 doses de vaccin, avec, pour le type d’HPV considéré dans l’analyse, un test ADN négatif ainsi qu’une sérologie négative au mois 0 et un test ADN négatif au mois 6). Cette cohorte a inclus des femmes avec une cytologie normale ou de bas grade à l’inclusion et a seulement exclu les femmes avec une cytologie de haut grade (0,5% de la population totale). L’évaluation du nombre de cas pour la cohorte ATP a commencé au jour 1 suivant la troisième dose de vaccin.
Globalement, 74% des femmes incluses étaient naïves à la fois vis-à-vis de HPV 16 et HPV 18 (c’est- à-dire ADN négatives et séronégatives à l’inclusion).
Deux analyses de l’étude HPV-008 ont été réalisées : la première analyse, prédéfinie dans le protocole comme l’analyse primaire de l’étude a été faite lorsque 36 cas de CIN2+ associés à l’HPV 16/18 ont été confirmés dans la cohorte ATP et une seconde analyse réalisée en prenant en compte l’ensemble des données de fin d’étude.
L’efficacité du vaccin vis-à-vis du critère principal CIN2+ à la fin de l’étude est présentée dans le tableau 1. Dans une analyse supplémentaire, l’efficacité de Cervarix a été évaluée vis-à-vis des CIN3+ associées aux HPV 16/18.
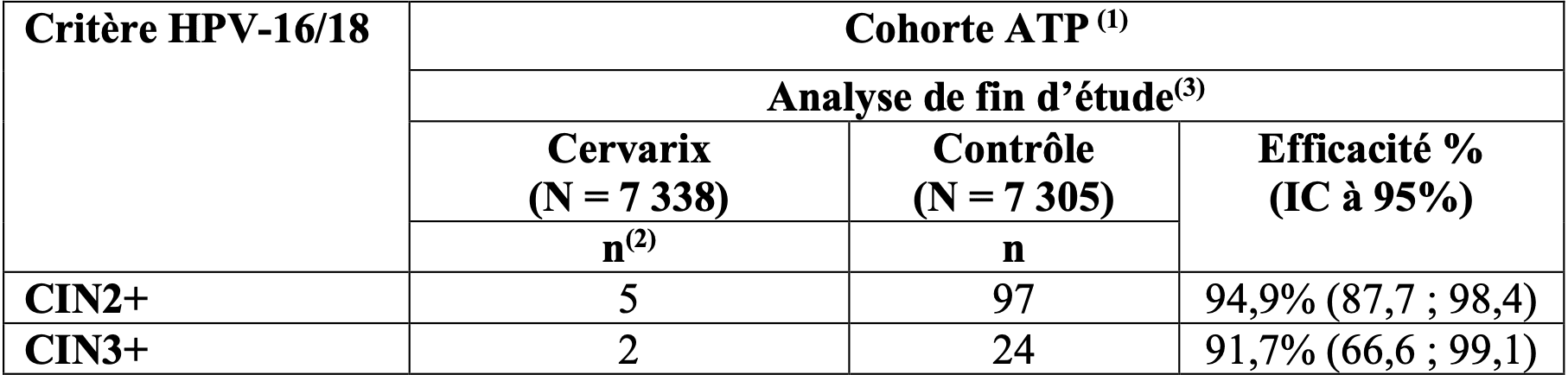
Tableau 1 : efficacité du vaccin contre les lésions de haut grade du col de l’utérus associées aux HPV 16/18 (cohorte ATP)

n = nombre de cas ;
1 ATP = inclut les femmes ayant reçu 3 doses de vaccin, avec, pour le type d’HPV considéré dans l’analyse (HPV 16 ou HPV 18), un test ADN négatif et une sérologie négative au mois 0 et un test ADN négatif au mois 6 ;
2 Incluant 4 cas de CIN2+ et 2 cas de CIN3+ dans lesquels un autre type d’HPVoncogène a été identifié dans la lésion en même temps qu’HPV 16 ou 18. Ces cassont exclus dans l’analyse d’attribution des types d’HPV (voir sous le tableau) ;
3 Suivi moyen de 40 mois post dose 3.
Dans l’analyse primaire, l’efficacité était de 92,9 % (IC à 96,1 %:79,9 ; 98,3) contre les CIN2+ et 80 % (IC à 96,1 %: 0,3 ; 98,1) contre les CIN3+. De plus, une efficacité du vaccin statistiquement significative a été démontrée contre les CIN2+ qu’elles soient associées à l’HPV 16 ou à l’HPV 18.
Pour les cas impliquant plusieurs types d'HPV, afin de distinguer le(s) type(s) d'HPV le(s) plus probablement responsable(s) de la lésion (attribution des types d'HPV), une analyse complémentaire a pris en compte les types d'HPV détectés par PCR (Polymerase Chain Reaction) dans au moins un des deux prélèvements cytologiques précédents, en plus des types détectés dans la lésion. Cette analyse post-hoc a exclu les cas (dans le groupe vaccin comme dans le groupe contrôle) qui n’ont pas été considérés comme étant imputables à des infections par HPV 16 ou HPV 18 acquises au cours de l’étude.
Sur la base de cette analyse post-hoc d’attribution des types d’HPV, il y a eu 1 cas de CIN2+ dans le groupe vaccin contre 92 cas dans le groupe contrôle (Efficacité 98,9 % (IC à 95 % : 93,8 ; 100)) et aucun cas de CIN3+ dans le groupe vaccin contre 22 cas dans le groupe contrôle (Efficacité 100 % (IC à 95 % : 81,8 ; 100)) à la fin de l’étude.
Dans l’analyse primaire, l’efficacité du vaccin vis-à-vis des CIN1 associés aux HPV 16/18 dans la cohorte ATP a été de 94,1 % (IC à 96,1 % : 83,4 ; 98,5). L’efficacité du vaccin vis-à-vis des CIN1+ associées aux HPV 16/18 dans la cohorte ATP a été de 91,7 % (IC à 96,1 % : 82,4 ; 96,7). A l’analyse de fin d’étude, l’efficacité du vaccin contre les CIN1 associées à l’HPV16/18 observée dans la cohorte ATP était de 92,8 % (IC à 95 % : 87,1 ; 96,4).
Dans l'analyse de fin d'étude, il y a eu 2 cas de VIN2+ ou VaIN2+ dans le groupe vacciné et 7 cas dans le groupe contrôle de la cohorte ATP, associés à l'HPV 16 ou à l'HPV 18. L'étude n'avait pas la puissance pour démontrer une différence entre le groupe vacciné et le groupe contrôle sur ces critères.
L’efficacité du vaccin dans la cohorte ATP à la fin de l’étude vis-à-vis des critères virologiques (infection persistante à 6 et à 12 mois) associés aux HPV 16/18 est présentée dans le tableau 2.
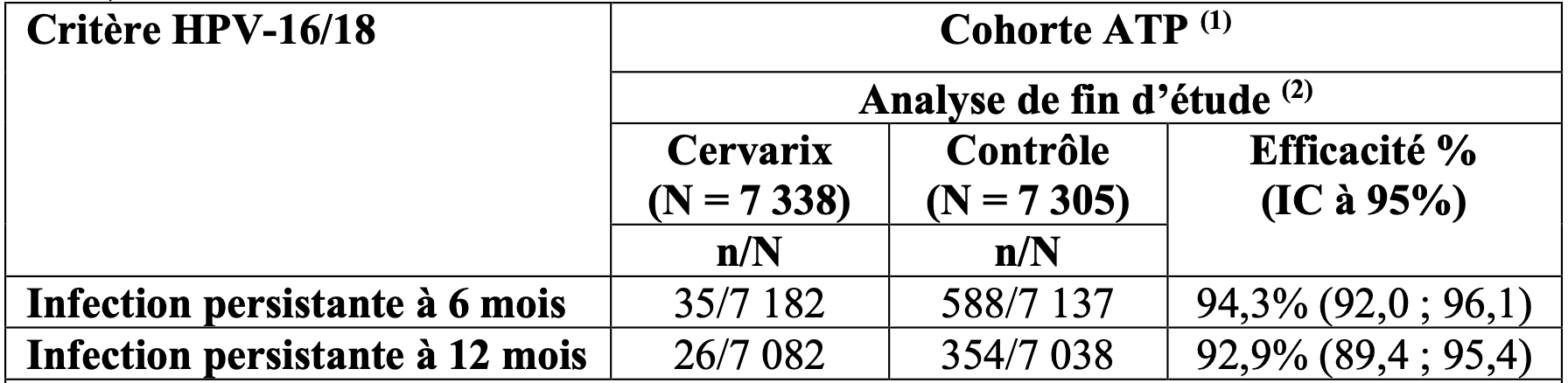
Tableau 2 : efficacité du vaccin vis-à-vis des critères virologiques associés aux HPV 16/18 (cohorte ATP)

n = nombre de cas ;
1 ATP = inclut les femmes ayant reçu 3 doses de vaccin, avec, pour le type d’HPVconsidéré dans l’analyse (HPV 16 ou HPV 18), un test ADN négatif et unesérologie négative au mois 0, et un test ADN négatif au mois 6 ;
2 Suivi moyen de 40 mois post dose 3.
Les résultats d’efficacité dans l’analyse primaire étaient de 94,3 % (IC à 96,1 % : 91,5 ; 96,3) contre l’infection persistante à 6 mois et 91,4 % (IC à 96,1 %: 89,4 ; 95,4) contre l’infection persistante à 12 mois.
2.4. Efficacité vis-à-vis d’HPV 16/18 chez les femmes ayant une infection prouvée par HPV 16 ou HPV 18 à l’inclusion dans l’étude
Il n’a pas été démontré de protection contre la maladie due aux types d’HPV pour lesquels les sujets étaient ADN HPV positifs à l’inclusion dans l’étude. Cependant, les sujets qui étaient déjà infectés (test ADN HPV positif) avant la vaccination par l’un des types d’HPV du vaccin ont été protégés des manifestations cliniques dues à l’autre type d’HPV du vaccin.
2.5. Efficacité vis-à-vis des HPV 16 et 18 chez les femmes avec et sans infection ou maladie antérieure.
La population totale vaccinée (TVC : Total Vaccinated Cohort) a inclus tous les sujets ayant reçu au moins une dose de vaccin, quels que soient leur statut ADN HPV, leur cytologie et leur statut sérologique à l’inclusion. Cette cohorte a inclus des femmes avec ou sans infection par HPV en cours et/ou antérieure. L’évaluation du nombre de cas pour la population TVC a commencé au jour 1 suivant la première dose de vaccin.
L’évaluation de l’efficacité est inférieure dans la population TVC car cette cohorte inclut les femmes ayant des infections/lésions préexistantes, sur lesquelles Cervarix n’est pas supposé avoir un impact. La population TVC est proche de la population générale des femmes de 15 à 25 ans.
L’efficacité du vaccin vis-à-vis des lésions cervicales de haut garde associées aux HPV 16/18 dans la population TVC est présentée dans le tableau 3.
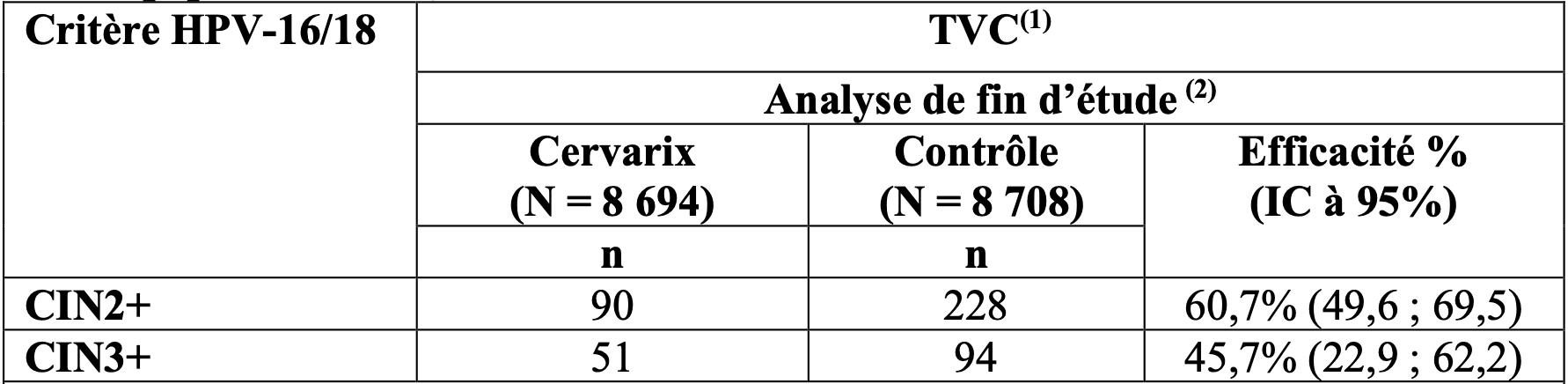
Tableau 3 : efficacité du vaccin vis-à-vis des lésions cervicales de haut grade associées aux HPV 16/18 (population TVC)

n = nombre de cas ;
1 TVC = inclut tous les sujets vaccinés (ayant reçu au moins une dose de vaccin) quelsque soient leur statut ADN HPV, leur cytologie et leur statut sérologique à l’inclusion. Cette cohorte inclut des femmes ayant des infections/lésions préexistantes ;
2 Suivi moyen de 44 mois post dose 1.
L’efficacité du vaccin vis-à-vis des critères virologiques (infection persistante à 6 et à 12 mois) associés aux HPV 16/18 dans la population TVC à la fin de l’étude est présentée dans le tableau 4.
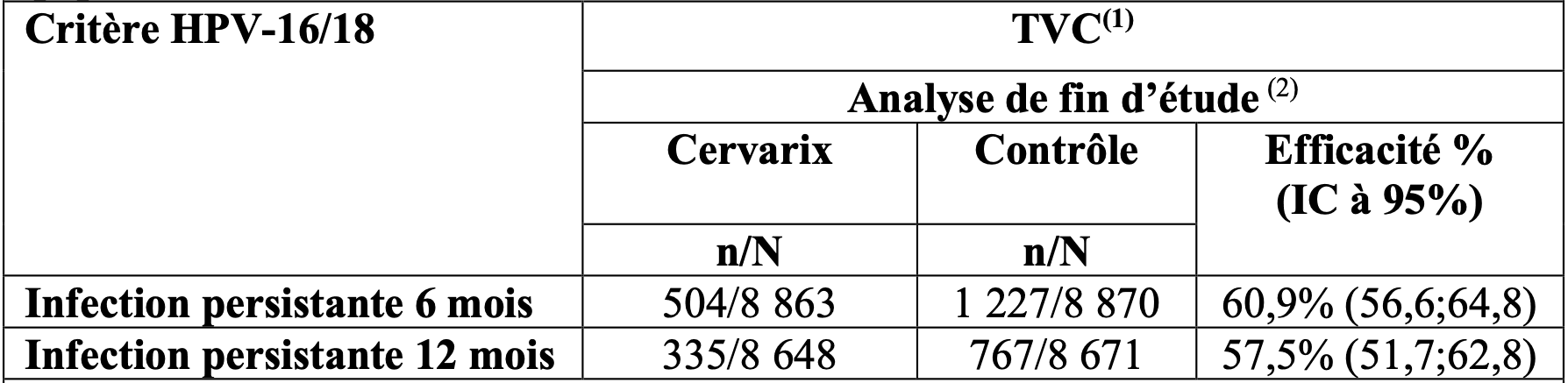
Tableau 4 : efficacité du vaccin vis-à-vis des critères virologiques associés aux HPV 16/18 (population TVC)

n = nombre de cas ;
1 TVC = inclut tous les sujets vaccinés (ayant reçu au moins une dose de vaccin) quels que soient leur statut ADN HPV, leur cytologie et leur statut sérologique à l’inclusion ;
2 Suivi moyen de 44 mois post dose 1.
2.6. Impact global du vaccin sur le fardeau des maladies du col de l’utérus dues aux HPV
Dans l’étude HPV-008, l’incidence des lésions cervicales de haut grade a été comparée entre le groupe placebo et le groupe vaccin quel que soit le type d’ADN HPV dans la lésion. L’efficacité du vaccin a été démontrée vis-à-vis des lésions cervicales de haut grade à la fin de l’étude dans les populations TVC et TVC-naïve (tableau 5).
La population TVC-naïve est un sous-groupe de la population TVC ; elle inclut les femmes qui, à l’inclusion, avaient une cytologie normale, un test ADN HPV négatif pour les 14 types d’HPV oncogènes et qui étaient séronégatives vis-à-vis d’HPV 16 et HPV 18.
Tableau 5 : efficacité du vaccin vis-à-vis des lésions cervicales de haut grade quel que soit le type d’ADN HPV dans la lésion
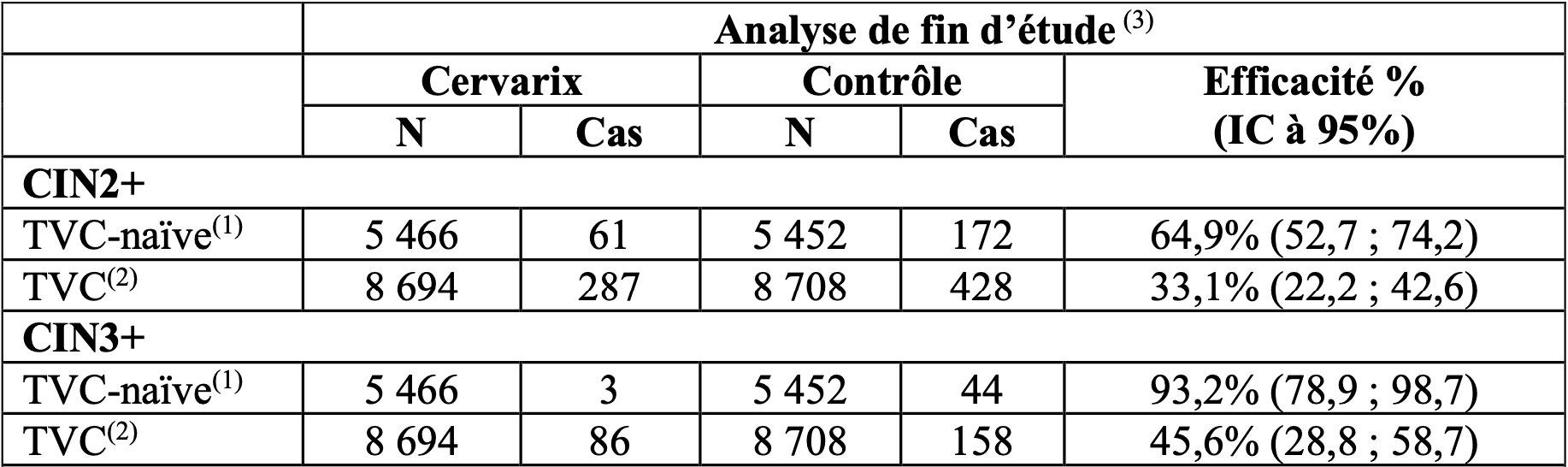

1 TVC-naïve = inclut tous les sujets vaccinés (ayant reçu au moins une dose de vaccin) qui, à l’inclusion, avaient une cytologie normale, un test ADN HPV négatif pour les 14 types d’HPV oncogènes et qui étaient séronégatifs vis-à-vis d’HPV 16 et HPV 18 ;
2 TVC = inclut tous les sujets vaccinés (ayant reçu au moins une dose de vaccin) quels que soient leur statut ADN HPV, leur cytologie et leur statut sérologique à l’inclusion ;
3 Suivi moyen de 44 mois post dose 1.
Dans l’analyse de fin d’étude, Cervarix a réduit les procédures d'excision cervicale (incluant les conisations à l’anse diathermique ou au bistouri et les procédures au laser) de 70,2 % (IC à 95 % : 57,8 ; 79,3) dans la population TVC-naïve et de 33,2 % (IC à 95 % : 20,8 : 43,7) dans la population TVC.
2.7. Efficacité due à une protection croisée
L’efficacité de Cervarix en terme de protection croisée vis-à-vis des critères histopathologiques et virologiques (infection persistante) a été évaluée dans l’étude HPV-008 pour les 12 types d’HPV oncogènes non vaccinaux. L’étude n’était assez puissante pour évaluer l’efficacité contre les maladies dues à un type d’HPV donné. L’analyse vis-à-vis du critère principal a été biaisée par de multiples co-infections dans les lésions CIN2+. Contrairement aux critères histopathologiques, les critères virologiques sont moins biaisés par des infections multiples.
Une protection croisée a été démontrée vis-à-vis des critères : infection persistante 6 mois et CIN2+ dans toutes les cohortes de l’étude pour HPV 31, 33 et 45.
L’efficacité du vaccin à la fin de l’étude vis-à-vis de l’infection persistante à 6 mois et des CIN2+ associées à chacun des types d’HPV oncogènes non vaccinaux est présentée dans le tableau 6 (cohorte ATP).
Tableau 6. : efficacité du vaccin pour les types d’HPV oncogènes non vaccinaux

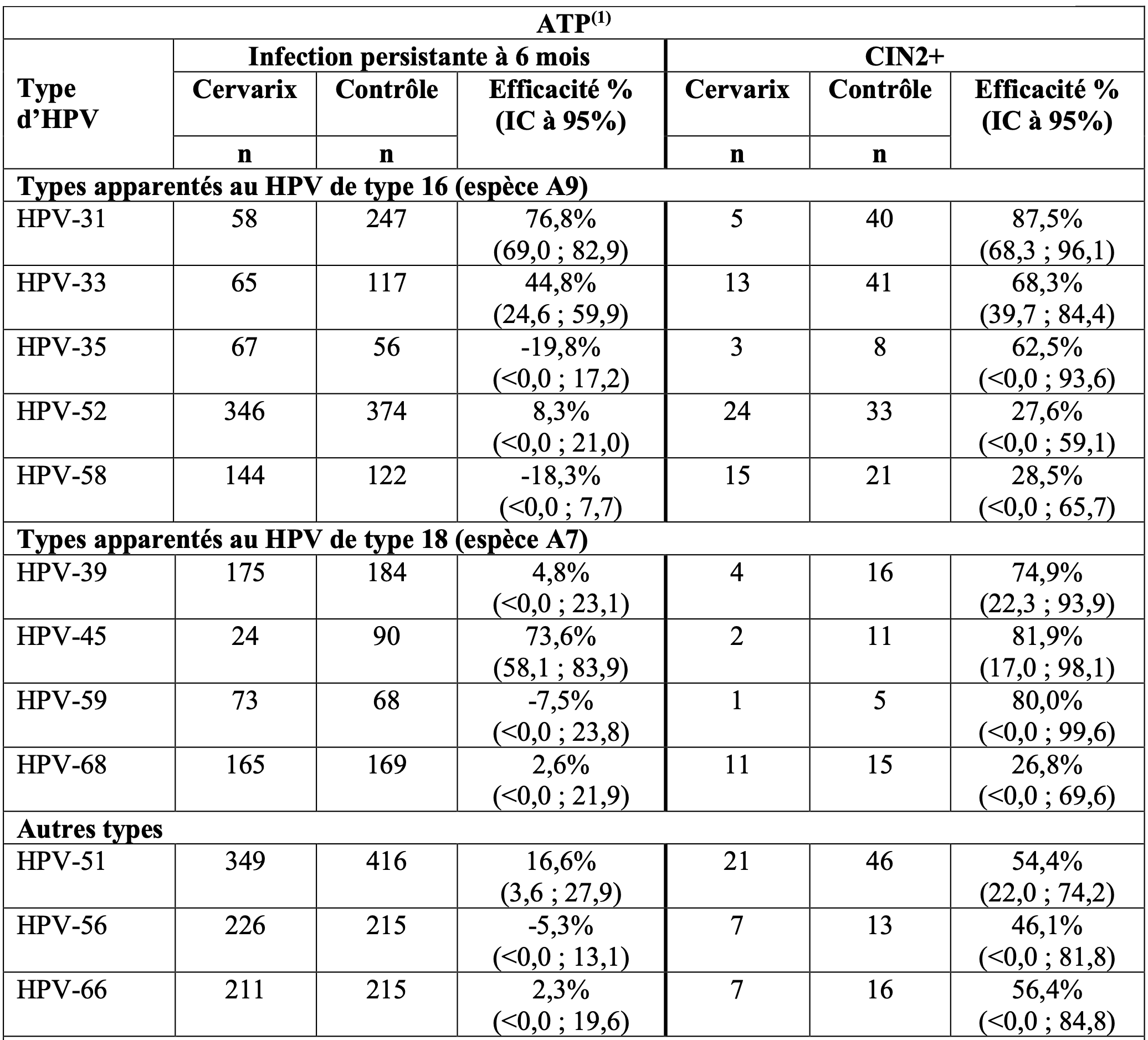
1 ATP = inclut les femmes ayant reçu 3 doses de vaccin, avec, pour le type d’HPV considéré dans l’analyse, un test ADN négatif au mois 0 et au mois 6 ;
Les limites de l’intervalle de confiance (IC) encadrant les valeurs de l’efficacité du vaccin ont été calculées. Quand la valeur zéro est incluse, c’est-à-dire quand la limite inférieure de l’IC est <0, l’efficacité n’est pas considérée comme statistiquement significative.
L’efficacité vis-à-vis des CIN3 a seulement été démontrée pour l’HPV-31 et il n’y avait aucune preuve de protection vis-à-vis des AIS quel que soit le type d’HPV.
2.8. Efficacité clinique chez les femmes âgées de 26 ans et plus
L’efficacité de Cervarix a été évaluée dans un essai clinique en double aveugle, randomisé de Phase III (HPV-015) qui a inclus un total de 5 778 femmes âgées de 26 à 72 ans (médiane : 37,0 ans). L’étude a été conduite en Amérique du Nord, en Amérique Latine, dans la région Asie Pacifique et en Europe. L'analyse finale a été réalisée à la conclusion de l'étude, 7 ans après la première vaccination. Le critère principal d'évaluation était une combinaison de critères virologiques et d'évaluation histopathologique : infection persistante à 6 mois liée à HPV-16/18 et / ou CIN1+.
Les analyses principales d’efficacité ont été réalisées sur la cohorte ATP pour l’efficacité et la population TVC qui comprenait un sous-groupe allant jusqu'à 15% de femmes ayant des antécédents d'infection ou de maladie associées à HPV (définis comme deux frottis ou plus successifs anormaux, une colposcopie anormale ou une biopsie ou un traitement du col de l'utérus après des résultats de frottis ou de colposcopie anormaux). L'inclusion de ce sous-groupe a permis l'évaluation de l'efficacité prophylactique dans une population censée refléter la situation en vie réelle puisque les femmes adultes sont dans la tranche d'âge généralement ciblée pour le dépistage cervical.
L’efficacité du vaccin à la conclusion de l'étude est résumée dans le tableau suivant.
Il n’a pas été prouvé que la prévention d'une infection persistante durant au moins 6 mois soit un marqueur de substitution pertinent de la prévention du cancer du col de l'utérus chez les femmes âgées de 26 ans et plus.
Tableau 7 : efficacité du vaccin à la conclusion de l’étude HPV-015

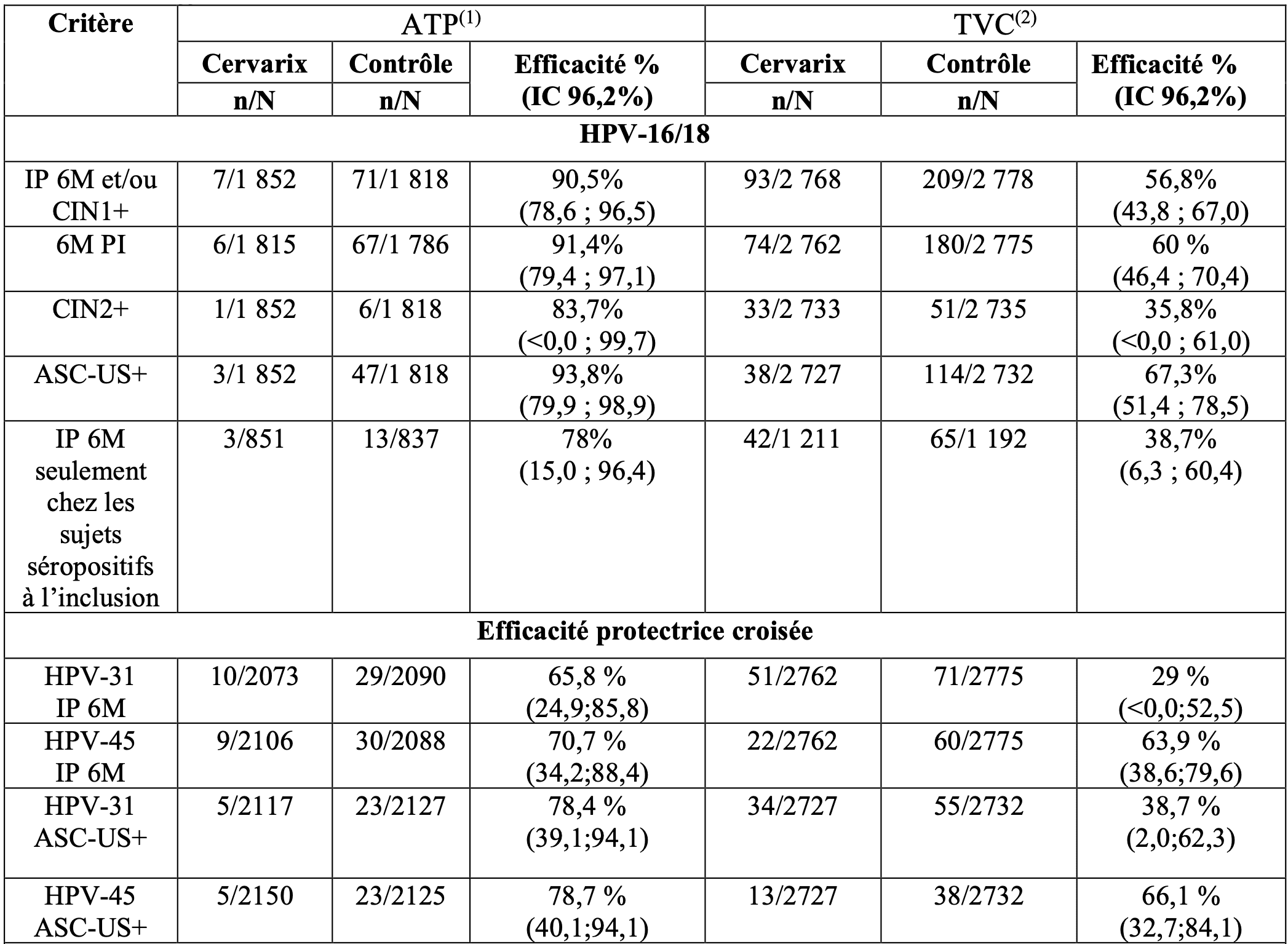
n = nombre de sujets rapportant au moins un événement dans chaque groupe ;
IP 6M = infection persistante à 6 mois ;
IC = Intervalle de Confiance ;
ASC-US = Cellules atypiques de signification non déterminée (cytologie anormale) ;
1 Inclut les femmes ayant reçu 3 doses de vaccin, avec, pour le type d’HPV considéré dans l’analyse (HPV 16 et/ou 18) : un test ADN négatif et une sérologie négative au mois 0 (sauf spécification) et un test ADN négatif au mois 6 ;
2 Au moins une dose de vaccin, quels que soient le test ADN et le statut sérologique au mois 0 (sauf spécification). Inclut 15% de sujets avec des antécédents de maladie/infection due à l’HPV.
L'efficacité vis-à-vis des ≥ ASC-US (cytologie anormale) associée à des oncogènes non vaccinaux était de 37,2 % (IC 96,2 % [21,3 ; 50,1]) (cohorte ATP).
Quel que soit le type de HPV détecté dans la lésion, l'efficacité vis-à-vis du CIN1+ était de 22,9 % (IC 96,2 % [4,8 ; 37,7]) (population TVC).
Il n'y a pas de preuve de protection contre la maladie causée par le HPV chez les sujets âgés de 25 ans et plus, qui avaient un test ADN positif et/ou avec une cytologie anormale à l'inclusion dans l'étude.
3. Immunogénicité
3.1. Réponse immunitaire à Cervarix après primovaccination
Il n’a pas été défini pour les vaccins HPV de taux minimum d’anticorps protecteur contre les CIN de grade 2 ou 3 ou contre l’infection persistante due aux types HPV contenus dans le vaccin.
La réponse en anticorps anti-HPV 16 et anti-HPV 18 a été mesurée en utilisant un test direct ELISA spécifique à chaque type (version 2, méthodologie MedImmune, modifié par GSK) et connu pour être corrélé au test de neutralisation utilisant des pseudovirions (PBNA : Pseudovirion-Based Neutralisation Assay).
L’immunogénicité induite par 3 doses de Cervarix a été évaluée chez 5 465 jeunes filles et femmes âgées de 9 à 55 ans et plus de 800 sujets de sexe masculin âgés de 10 à 18 ans.
Dans les études cliniques, plus de 99 % des sujets initialement séronégatifs ont eu une séroconversion après la troisième dose aux HPV à la fois de types 16 et 18. La moyenne géométrique des titres (MGT) en IgG induites par le vaccin était largement au dessus des titres observés chez les femmes qui avaient été précédemment infectées mais qui avaient éliminé l’infection (infection naturelle). Les sujets initialement séropositifs et séronégatifs ont atteint des taux similaires après vaccination.
3.2. Persistance de la réponse immunitaire à Cervarix
L’étude 001/007 (qui a inclus des femmes âgées de 15 à 25 ans au moment de la vaccination) a évalué la réponse immunitaire contre les HPV 16 et les HPV 18 jusqu’à 76 mois après l’administration de la première dose de vaccin. Dans l’étude 023 (sous-groupe de l’étude 001/007), l’évaluation de la réponse immunitaire a continué jusqu’à 113 mois. 92 sujets dans le groupe vacciné avaient des données d’immunogénicité à l’intervalle [M107-M113] après la première dose de vaccin avec un suivi médian de 8,9 ans. Parmi ces sujets, 100 % des femmes (IC 95 % : 96,1 ; 100) sont restées séropositives vis-à-vis d’HPV 16 et HPV 18 selon le test ELISA.
Les MGTs en IgG induites par le vaccin pour, à la fois, HPV 16 et HPV 18, présentaient un pic au mois 7 et diminuaient ensuite pour atteindre un plateau à partir du mois 18 jusqu’à l’intervalle [M107-M113] avec des MGTs (test ELISA) pour HPV 16 et HPV 18 au moins encore 10 fois supérieures aux MGTs observées (test ELISA) chez les femmes qui avaient éliminé une infection naturelle par HPV.
Dans l’étude 008, l’immunogénicité jusqu’au mois 48 a été similaire à la réponse observée dans l’étude 001. Un profil cinétique similaire a été observé pour les anticorps neutralisants.
Dans une autre étude clinique (étude 014) réalisée chez des femmes âgées de 15 à 55 ans, la séroconversion a été obtenue chez tous les sujets vis-à-vis des 2 types d’HPV 16 et 18 après la troisième dose (au mois 7). Les MGT étaient cependant moins élevées chez les femmes de plus de 25 ans. Quatre cent soixante-dix sujets (142 âgés de 15 à 25 ans, 172 âgés de 26 à 45 ans et 156 âgés de 46 à 55 ans) ayant terminé l'étude HPV-014 et ayant reçu un schéma en 3 doses, ont été suivis jusqu’à 10 ans dans l'étude d’extension HPV-60. Dix ans après l'administration de la première dose, 100 % des sujets du groupe des 15-25 ans, 99,2 % des sujets du groupe des 26-45 ans et 96,3 % des sujets du groupe des 46-55 ans étaient toujours séropositifs pour le HPV-16 et respectivement 99,2 %, 93,7 % et 83,8 % pour le HPV-18. Dans tous les groupes d'âge, les MGT sont restées au moins 5 à 32 fois pour le HPV-16 et 3 à 14 fois pour le HPV-18 au-dessus de celles induites chez les femmes qui ont éliminé une infection naturelle pour ces deux antigènes.
3.3. Existence d’une réponse anamnestique (mémoire immunitaire)
Dans l’étude 024 (un sous-groupe de l’étude 001/007), une dose additionnelle de Cervarix a été administrée à 65 sujets à un intervalle moyen de 6,8 ans après la première dose de vaccin. Une réponse immunitaire anamnestique vis-à-vis d’HPV 16 et d’HPV 18 (mesurée par le test ELISA) a été observée une semaine et un mois après cette dose additionnelle ; les MGT un mois après cette dose additionnelle dépassaient les MGT observées un mois après la primovaccination en 3 doses.
3.4. Extrapolation de l’efficacité de Cervarix des jeunes femmes adultes aux adolescentes.
Dans une analyse combinée (HPV-029, -30 et -48), la séroconversion a été obtenue chez 99,7 % et 100 % des filles de 9 ans vis-à-vis, respectivement, des types d’HPV 16 et 18, après la troisième dose (au mois 7) avec des MGTs au moins 1,4 et 2,4 fois plus élevées que celles des filles âgées de 10 à 14 ans et des femmes âgées de 15 à 25 ans, respectivement.
Dans les deux études cliniques (HPV-012 et -013) réalisées chez des filles âgées de 10 à 14 ans, la séroconversion a été obtenue chez tous les sujets vis-à-vis des 2 types d’HPV 16 et 18 après la troisième dose (au mois 7) avec une MGT au moins 2 fois plus élevée que celle des femmes âgées de 15 à 25 ans.
Dans des essais cliniques (HPV-070 et HPV-048) réalisés chez des filles âgées de 9 à 14 ans recevant Cervarix selon un schéma en 2 doses (0, 6 mois ou 0, 12 mois) et des jeunes femmes âgées de 15 à 25 ans recevant Cervarix selon le schéma standard en 3 doses (0, 1, 6 mois), tous les sujets ont séroconverti aux 2 types d’HPV 16 et 18 un mois après la seconde dose. La réponse immunitaire après 2 doses chez des filles âgées de 9 à 14 ans a été non inférieure à la réponse après 3 doses chez des femmes âgées de 15 à 25 ans.
L’efficacité de Cervarix chez les filles âgées de 9 à 14 ans a été déduite de ces données d’immunogénicité.
3.5. Durée de la réponse immunitaire chez les femmes âgées de 26 ans et plus
Dans l’étude de Phase III (HPV-015) chez des femmes âgées de 26 ans et plus tous les sujets ont séroconverti 1 mois après la troisième dose. Au mois 84, c’est-à-dire 78 mois après la réalisation complète du schéma de vaccination, 99,3 % et 95,9 % des femmes initialement séronégatives sont devenues séropositives pour les anticorps anti-HPV-16 et anti-HPV-18, respectivement. Toutes les femmes initialement séropositives sont restées séropositives pour les anticorps à la fois anti-HPV-16 et anti-HPV-18.
Les titres en anticorps ont atteint leur maximum au mois 7 puis ont progressivement diminué jusqu’au mois 18 et se sont stabilisés pour atteindre un plateau jusqu’au mois 84.
3.6. Immunogénicité chez les hommes âgés de 10 à 18 ans
L’immunogénicité chez les hommes a été évaluée au cours de 2 essais cliniques HPV-011 (N = 173) et HPV-040 (N = 556). Les données ont montré une immunogénicité comparable chez l’homme et chez la femme. Dans l'étude HPV-011, tous les sujets ont séroconverti à HPV 16 et 18 et les MGT étaient non inférieurs à ceux observés dans l'étude HPV-012 chez les femmes âgées de 15 à 25 ans.
3.7. Extrapolation des données d’efficacité clinique sur les lésions pré-cancéreuses et cancers de l'anus
Aucune étude d'efficacité sur les lésions précancéreuses anales n’a été menée avec Cervarix. Cependant, des études menées chez les filles âgées de 9 à 14 ans (étude HPV-071) et chez les femmes âgées de 18 à 45 ans (étude HPV-010) ont montré de manière constante, une réponse immunitaire supérieure de Cervarix versus le comparateur pour lequel les données d’efficacité sur les lésions précancéreuses anales ont été concluantes et ont montré une protection.
3.8. Immunogénicité chez les femmes infectées par le VIH
Deux études cliniques ont évalué la tolérance et l'immunogénicité de Cervarix.
- Dans l'étude HPV-020, réalisée en Afrique du Sud, 22 sujets non infectés par le VIH et 42 sujets infectés par le VIH (stade clinique de niveau 1 selon la classification OMS; cohorte ATP pour l'immunogénicité) ont reçu Cervarix.
- L'étude HPV-019, une étude comparative entre Cervarix et un vaccin HPV quadrivalent, a été menée au Brésil, e, Estonie, en Inde et en Thaïlande chez 289 sujets de sexe féminin non infectés par le VIH (cohorte ATP = 157) et 257 sujets de sexe féminin infectés par le VIH (cohorte ATP = 166), âgés de 15 à 25 ans.
Lors de l'inclusion, les sujets infectés par le VIH devaient dans les deux études être asymptomatiques indépendamment de leur stade clinique antérieur; avoir une charge virale indétectable (c'est-à-dire une charge virale < 400 copies/mL) pendant au moins six mois sous traitement antirétroviral (ART) (HPV-020) ou pendant au moins un an sous traitement antirétroviral hautement actif (HAART) (HPV-019); ne pas être diagnostiqués d'une tuberculose active (TB) ou suivre un traitement antituberculeux; dans l'étude HPV-019 uniquement-avoir un nombre de cellules CD4 > 350 cellules/mm3.
Dans les deux études, une séroconversion de 100 % a été observée au mois 7 pour les deux antigènes, chez les sujets infectés par le VIH recevant Cervarix, au sein de la cohorte ATP. Dans l'étude HPV-019, la séropositivité au mois 24 après la vaccination par Cervarix était de 100% pour les anticorps HPV-16 et > 96% pour les anticorps HPV-18, avec une moyenne géométrique des concentrations (MGC) plus de 12 fois supérieure à la réponse à une infection naturelle par le HPV. Dans les deux études, les MGCs en anticorps chez les sujets infectés par le VIH sont apparues inférieures à celles des sujets VIH négatifs (pas de recoupement de l'intervalle de confiance à 95 %).
Dans l'étude HPV-19, la supériorité des réponses immunitaires (ratios des MGT en anticorps neutralisants) aux deux antigènes HPV-16 et HPV-18 a été démontrée avec Cervarix par rapport au vaccin HPV quadrivalent, au mois 7 chez les sujets infectés par le VIH. La pertinence clinique de ces observations est inconnue. Aucune donnée d'efficacité clinique n'existe sur la protection contre l'infection persistante ou les lésions précancéreuses chez les femmes infectées par le VIH. La réactogénicité et le profil de tolérance de Cervarix observés chez les femmes infectées par le VUH étaient cohérents avec le profil de tolérance connu chez les sujets sains ( voir rubrique "Effets indésirables").
Conservation
Durée de conservation :5 ans.
A conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler.
A conserver dans l’emballage extérieur d’origine à l’abri de la lumière.
Cervarix doit être administré dès que possible après avoir été sorti du réfrigérateur.
Toutefois, la stabilité a été démontrée lorsqu’il a été conservé hors du réfrigérateur jusqu’à 3 jours à des températures comprises entre 8 °C et 25 °C, ou jusqu’à 1 jour à des températures comprises entre 25 °C et 37 °C. Le vaccin sera jeté s’il n’a pas été utilisé à la fin de cette période.
Flacon multidose
Il est recommandé d’utiliser le flacon immédiatement après son ouverture. Si le flacon n’est pas utilisé immédiatement, il doit être conservé au réfrigérateur (2 °C – 8 °C) au maximum pendant 6 heures. Au-delà des 6 heures, il doit être éliminé.
Manipulation
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments.
Seringue préremplie
Durant le stockage de la seringue, un fin dépôt blanc avec un surnageant incolore et limpide peut être observé. Ceci n’est pas un signe de détérioration.
Avant administration, le contenu de la seringue doit être inspecté visuellement, avant et après agitation, pour détecter la présence éventuelle de toute particule étrangère et/ou altération de l’aspect physique.
Si l’un ou l’autre cas est observé, jetez le vaccin.
Le vaccin doit être bien agité avant utilisation.
Instructions d’utilisation de la seringue préremplie
 |
|
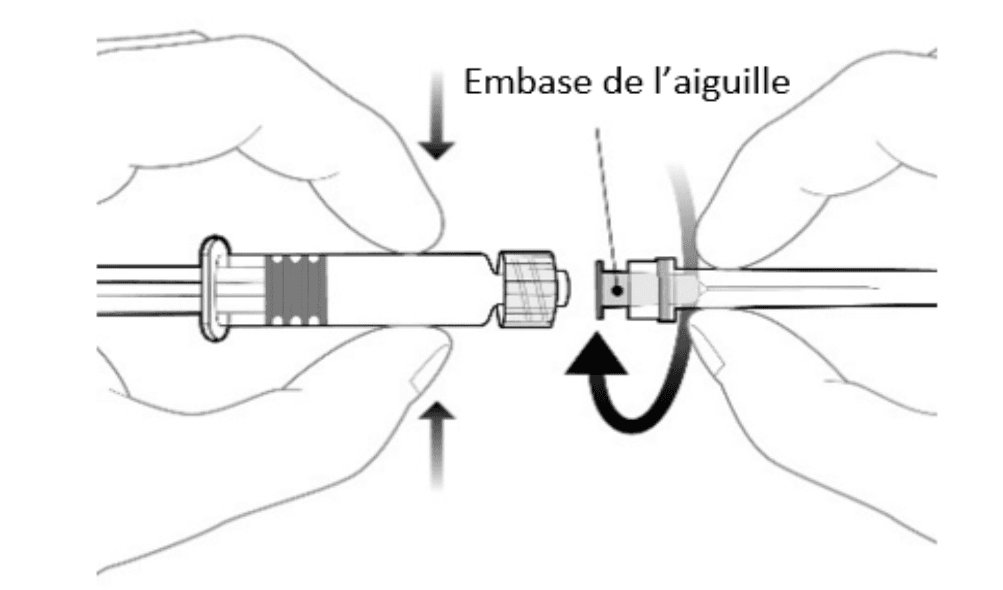 |
|
Flacon
Durant le stockage du flacon, un fin dépôt blanc avec un surnageant incolore et limpide peut être observé. Ceci n’est pas un signe de détérioration.
Avant administration, le contenu du flacon doit être inspecté visuellement, avant et après agitation, pour détecter la présence éventuelle de toute particule étrangère et/ou altération de l’aspect physique. Si l’un ou l’autre cas est observé, jetez le vaccin.
Le vaccin doit être bien agité avant utilisation.
Flacon multidose
Durant le stockage du flacon, un fin dépôt blanc avec un surnageant incolore et limpide peut être observé. Ceci n’est pas un signe de détérioration.
Avant administration, le contenu du flacon doit être inspecté visuellement, avant et après agitation, pour détecter la présence éventuelle de toute particule étrangère et/ou altération de l’aspect physique. Si l’un ou l’autre cas est observé, jetez le vaccin.
Le vaccin doit être bien agité avant utilisation.
Lors de l’utilisation d’un flacon multidose, chaque dose de 0,5 mL doit être prélevée en utilisant une aiguille et une seringue stériles ; des précautions doivent être prises pour éviter la contamination du contenu.
L'administration du vaccin doit être consignée par le médecin sur le carnet de vaccination ou de santé avec le numéro de lot. Il peut aussi être inscrit par le patient ou son médecin sur un carnet de vaccination numérique (version grand public ou professionnelle).
Instructions d’élimination
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Autres informations
Données de sécurité précliniques
Les données non cliniques issues des études conventionnelles de sécurité pharmacologique, toxicité avec une dose unique et/ou avec des doses répétées, tolérance locale, fertilité, toxicité embryologique, foetale et post-natale (jusqu’à la fin de la période de lactation), n’ont pas révélé de risque particulier pour l’Homme.
Les données sérologiques suggèrent un passage des anticorps anti-HPV 16 et anti-HPV 18 dans le lait durant la période de lactation chez le rat. Cependant, on ne sait pas si les anticorps induits par la vaccination sont excrétés dans le lait maternel humain.
Remboursement
Remboursé par la Sécurité Sociale à 65 % dans le cas suivant :
- prévention des infections dues à certains papillomavirus humains (HPV), selon le calendrier vaccinal en vigueur (de 11 à 19 ans révolus).
Cette présentation est agréée aux collectivités.