QDENGA
Laboratoire : Takeda Vaccines
Avril 2025 : nouvelles recommandations vaccinales pour les voyageurs. Ces recommandations concernent les personnes âgées de 6 ans et plus, et prennent en compte l'âge du voyageur, la présence ou non de comorbidités connues pour accroître le risque d'évolution vers une dengue grave, les antécédents personnels de dengue, et l'épidémiologie de la maladie.
Ce vaccin est disponible en pharmacie d'officine depuis le 21 janvier 2025.
Avis HAS du 12 décembre 2024. Vaccination recommandée dans les territoires français d'Amérique, à Mayotte et à La Réunion pour :
- Les enfants de 6 à 16 ans ayant déjà eu une infection par la dengue.
- Les adultes de 17 à 60 ans avec des comorbidités, qu'ils aient ou non un antécédent d'infection.
Vaccin autorisé par l'Union européenne le 8 décembre 2022.
Fiche mise à jour le 16/07/2025 à partir du RCP du 08/07/2025 (principalement « Effets indésirables » et « Pharmacodynamie »). Ce vaccin peut être administré avec le vaccin amaril ou un vaccin anti-HPV.
Description
Vaccin vivant atténué, chimérique recombinant, quadrivalent contre les quatre sérotypes (1, 2, 3 et 4) du virus de la dengue. Autres noms : TAK-003 ; DENVAX ; DENGUE TETRAVALENT VACCINE (LIVE, ATTENUATED) TAKEDA.
Forme et Présentation
▼ Ce symbole indique que ce vaccin fait l'objet d'une surveillance supplémentaire. Cela permettra d'identifier rapidement de nouvelles informations de sécurité. Il est demandé aux professionnels de santé de signaler tout effet indésirable suspecté.
Vaccin tétravalent contre la dengue (vivant, atténué).
Poudre et solvant pour solution injectable.
Avant la reconstitution, le vaccin est une poudre lyophilisée de couleur blanc à blanc cassé (agglomérat compact).
Le solvant est une solution limpide et incolore.
Nature et contenu de l'emballage extérieur
Qdenga, poudre et solvant pour solution injectable :
- Poudre (1 dose) en flacon en verre (verre de type I), avec un bouchon (caoutchouc butyle) et une capsule en aluminium avec capuchon amovible en plastique vert + 0,5 mL de solvant (1 dose) en flacon en verre (verre de type I), avec un bouchon (caoutchouc bromobutyle) et une capsule en aluminium avec capuchon amovible en plastique violet.
Boîte de 1 ou 10.
Qdenga, poudre et solvant pour solution injectable en seringue pré-remplie :
- Poudre (1 dose) en flacon (verre de type I), avec un bouchon (caoutchouc bromobutyle) et une capsule en aluminium avec capuchon amovible en plastique vert + 0,5 mL de solvant (1 dose) en seringue pré-remplie (verre de type I), avec un bouchon de piston (bromobutyle) et une coiffe d’embout (polypropylène), avec 2 aiguilles distinctes.
Boîte de 1 ou 5. - Poudre (1 dose) en flacon (verre de type I), avec un bouchon (caoutchouc butyle) et capsule en aluminium avec capuchon amovible en plastique vert + 0,5 mL de solvant (1 dose) en seringue pré-remplie (verre de type I), avec un bouchon de piston (bromobutyle) et une coiffe d’embout (polypropylène, sans aiguille.
Boîte de 1 ou 5.
Toutes les présentations peuvent ne pas être commercialisées.
Composition
Après reconstitution, une dose (0,5 mL) contient :
1. Antigènes
- Sérotype 1 du virus de la dengue (vivant, atténué)1: ≥ 3,3 log10UFP3/dose
- Sérotype 2 du virus de la dengue (vivant, atténué)2: ≥ 2,7 log10UFP3/dose
- Sérotype 3 du virus de la dengue (vivant, atténué)1: ≥ 4,0 log10UFP3/dose
- Sérotype 4 du virus de la dengue (vivant, atténué)1: ≥ 4,5 log10UFP3/dose
1 : produit dans des cellules Vero à l’aide de la technologie de l’ADN recombinant. Gènes des protéines de surface spécifiques au sérotype intégrés dans le génome de la dengue de type 2. Ce produit contient des organismes génétiquement modifiés (OGM) ;
2 : produit dans des cellules Vero à l’aide de la technologie de l’ADN recombinant ;
3 : UFP = unités formant plages.
2. Excipients
Poudre
- α,α-Tréhalose dihydraté
- Poloxamère 407
- Albumine sérique humaine
- Dihydrogénophosphate de potassium
- Hydrogénophosphate disodique
- Chlorure de potassium
- Chlorure de sodium
Solvant
- Chlorure de sodium
- Eau pour préparations injectables
Indications
Qdenga est indiqué pour la prévention de la dengue chez des sujets à partir de l’âge de 4 ans.
L’utilisation de Qdenga doit être conforme aux recommandations officielles.
Face à l'augmentation des cas de dengue dans les Outre-mer, la Haute Autorité de santé (HAS) recommande l'utilisation du vaccin QDENGA pour prévenir la dengue symptomatique. La vaccination est préconisée dans les territoires français d'Amérique, à Mayotte et à La Réunion pour :
- Les enfants de 6 à 16 ans ayant déjà eu une infection par la dengue.
- Les adultes de 17 à 60 ans avec des comorbidités, qu'ils aient ou non un antécédent d'infection.
Posologie
1. Sujets à partir de l’âge de 4 ans
Qdenga doit être administré sous la forme d’une dose de 0,5 mL selon un schéma à deux doses (0 et 3 mois).
La nécessité d’une dose de rappel n’a pas été établie.
2. Autre population pédiatrique (enfants âgés de moins de 4 ans)
La sécurité et l’efficacité de Qdenga chez les enfants âgés de moins de 4 ans n’ont pas été établies. Les données actuellement disponibles sont décrites à la rubrique "Effets indésirables" mais aucune recommandation sur la posologie ne peut être donnée.
3. Sujets âgés
Aucun ajustement de la posologie n’est nécessaire chez les personnes âgées ≥ 60 ans. Voir la rubrique "Mises en garde et précautions d'emploi".
Mode d'administration
Après avoir terminé la reconstitution du vaccin lyophilisé avec le solvant, Qdenga doit être administré par injection sous-cutanée de préférence dans le haut du bras, dans la région du muscle deltoïde.
Qdenga ne doit pas être injecté par voie intravasculaire, intradermique ni intramusculaire.
Le vaccin ne doit pas être mélangé à d’autres vaccins ou médicaments parentéraux dans la même seringue.
Pour les instructions concernant la reconstitution de Qdenga avant administration, voir la rubrique "Manipulation".
Contre-indications
- Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique "Composition" ou hypersensibilité à une dose antérieure de Qdenga.
- Sujets présentant un déficit immunitaire congénital ou acquis, y compris ceux recevant des traitements immunosuppresseurs comme des doses élevées de corticostéroïdes systémiques (par ex. 20 mg/jour ou 2 mg/kg de poids corporel par jour de prednisone pendant 2 semaines ou plus) dans les 4 semaines précédant la vaccination, ou tout autre médicament ayant des propriétés immunosuppressives connues, y compris une chimiothérapie. La durée pendant laquelle la vaccination doit être évitée après un traitement immunosuppresseur doit être évaluée au cas par cas.
- Sujets présentant une infection au VIH symptomatique ou une infection au VIH asymptomatique accompagnée de signes d’altération de la fonction immunitaire.
- Les femmes enceintes (voir rubrique "Grossesse").
- Les femmes allaitantes (voir rubrique "Allaitement").
Mises en garde et précautions d'emploi
1. Traçabilité
Afin d’améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
2. Recommandations générales
Anaphylaxie
Des cas d’anaphylaxie ont été signalés chez des personnes ayant été vaccinées avec Qdenga. Comme pour tous les vaccins injectables, une surveillance médicale et des traitements appropriés doivent toujours être immédiatement proposés en cas de survenue d’une réaction anaphylactique rare suivant l’administration du vaccin.
Examen des antécédents médicaux
La vaccination doit être précédée d’un examen des antécédents médicaux du sujet (en particulier en ce qui concerne les vaccinations antérieures et les possibles réactions d’hypersensibilité survenues après une vaccination).
Maladie concomitante
La vaccination par Qdenga doit être reportée chez les sujets présentant une maladie fébrile sévère aiguë. En revanche, la présence d’une infection mineure, telle qu’un rhume, ne justifie pas le report de la vaccination.
Limites de l’efficacité du vaccin
Il est possible qu’une réponse immunitaire protectrice avec Qdenga ne soit pas obtenue contre tous les sérotypes du virus de la dengue chez tous les sujets vaccinés et peut diminuer avec le temps (voir rubrique "Pharmacodynamie"). Il n’est actuellement pas établi si un manque de protection pourrait entraîner une augmentation de la gravité de la dengue. Il est recommandé de continuer à prendre des mesures de protection personnelle contre les piqûres de moustiques après la vaccination. Les sujets doivent demander des soins médicaux s’ils développent des symptômes de la dengue ou des signes indicateurs de la dengue.
Aucune donnée sur l’utilisation de Qdenga chez des sujets de plus de 60 ans n’est disponible. Des données limitées chez les patients souffrant d’affections médicales chroniques sont disponibles.
Réactions liées à l’anxiété
Des réactions liées à l’anxiété, notamment des réactions vasovagales (syncope), une hyperventilation ou des réactions liées au stress peuvent survenir avec la vaccination, sous forme de réponse psychogène à l’injection par aiguille. Il est important que des précautions soient prises afin d’éviter toute blessure résultant d’un évanouissement.
Femmes en âge de procréer
Comme avec d’autres vaccins vivants atténués, les femmes en âge de procréer doivent éviter une grossesse pendant au moins un mois après la vaccination (voir rubriques "Grossesse" et Contre-indications).
Autres
Qdenga ne doit pas être administré par injection intravasculaire, intradermique ni intramusculaire.
3. Excipients
Qdenga contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu’il est essentiellement « sans sodium ».
Qdenga contient moins de 1 mmol (39 mg) de potassium par dose, c.-à-d. qu’il est essentiellement « sans potassium ».
Interactions
Pour les patients recevant un traitement par des immunoglobulines ou des produits sanguins contenant des immunoglobulines, tels que du sang ou du plasma, il est recommandé d’attendre au moins 6 semaines, et de préférence 3 mois, après la fin du traitement avant d’administrer Qdenga, afin d’éviter une neutralisation des virus vivants atténués contenus dans le vaccin.
Qdenga ne doit pas être administré aux sujets ayant reçu des traitements immunosuppresseurs comme des doses élevées de corticostéroïdes systémiques dans les 4 semaines précédant la vaccination, ou tout autre médicament ayant des propriétés immunosuppressives connues, y compris une chimiothérapie (voir rubrique "Contre-indications"). La durée pendant laquelle la vaccination doit être évitée après un traitement immunosuppresseur doit être évaluée au cas par cas.
Utilisation avec d’autres vaccins :
Si Qdenga doit être administré en même temps qu’un autre vaccin injectable, le ou les vaccins doivent alors toujours être administrés en des sites d’injection différents.
Qdenga peut être administré en même temps qu’un vaccin contre l’hépatite A. L’administration concomitante a été étudiée chez les adultes.
Qdenga peut être administré en même temps qu’un vaccin contre la fièvre jaune. Dans une étude clinique incluant environ 300 sujets adultes ayant reçu Qdenga en même temps que le vaccin contre la fièvre jaune 17D, il n’y a eu aucun effet sur le taux de séroprotection contre la fièvre jaune. Les réponses par anticorps contre la dengue ont diminué suite à l’administration concomitante de Qdenga et du vaccin contre la fièvre jaune 17D. La signification clinique de cette observation est inconnue.
Qdenga peut être administré en même temps qu’un vaccin contre le papillomavirus humain (HPV) (voir rubrique "Pharmacodynamie").
Fertilité
Les études effectuées chez l’animal sont insuffisantes pour permettre de conclure sur la toxicité sur la reproduction (voir rubrique "Autres informations / Données de sécurité préclinique").
Aucune étude spécifique n’a été réalisée sur la fertilité chez l’être humain.
Grossesse
Les études effectuées chez l’animal sont insuffisantes pour permettre de conclure sur la toxicité sur la reproduction (voir rubrique "Autres informations / Données de sécurité préclinique").
Il existe des données limitées sur l’utilisation de Qdenga chez la femme enceinte. Ces données ne sont pas suffisantes pour conclure à l’absence d’effets potentiels de Qdenga sur la grossesse, le développement embryo-fœtal, la parturition et le développement postnatal.
Qdenga est un vaccin vivant atténué, par conséquent, il est contre-indiqué pendant la grossesse (voir rubrique "Contre-indications").
Femmes en âge de procréer
Les femmes en âge de procréer doivent éviter une grossesse pendant au moins un mois après la vaccination. Il convient de conseiller de retarder la vaccination chez les femmes qui envisagent une grossesse (voir rubriques "Mises en garde et précautions d'emploi" et "Contre-indications").
Fertilité
Les études effectuées chez l’animal sont insuffisantes pour permettre de conclure sur la toxicité sur la reproduction (voir rubrique "Autres informations / Données de sécurité préclinique").
Aucune étude spécifique n’a été réalisée sur la fertilité chez l’être humain.
Allaitement
On ne sait pas si Qdenga est excrété dans le lait maternel humain. Un risque pour les nouveau- nés/nourrissons ne peut être exclu.
Qdenga est contre-indiqué pendant l’allaitement (voir rubrique "Contre-indications").
Effets indésirables
1. Résumé du profil de sécurité
Dans les études cliniques, les réactions les plus fréquemment signalées chez les sujets de 4 à 60 ans étaient une douleur au site d’injection (50 %), des maux de tête (35 %), une myalgie (31 %), un érythème au site d’injection (27 %), un malaise (24 %), une asthénie (20 %) et de la fièvre (11 %).
Ces réactions indésirables survenaient généralement dans les 2 jours suivant l’injection, étaient de gravité légère à modérée, de courte durée (1 à 3 jours) et étaient moins fréquentes après la deuxième injection de Qdenga qu’après la première.
2. Virémie vaccinale
Dans l’étude clinique DEN-205, une virémie vaccinale transitoire a été observée après la vaccination par Qdenga chez 49 % des participants à l’étude qui n’avaient pas été infectés par la dengue auparavant et chez 16 % des participants à l’étude qui avaient été infectés par la dengue auparavant. La virémie vaccinale débutait généralement au cours de la deuxième semaine après la première injection et avait une durée moyenne de 4 jours. La virémie vaccinale était associée à des symptômes transitoires, légers à modérés, tels que maux de tête, arthralgie, myalgie et éruption cutanée chez certains sujets. Ces symptômes peuvent également être observés en cas de dengue. La virémie vaccinale a rarement été détectée après la deuxième dose.
Les tests diagnostiques de la dengue peuvent être positifs lors de la virémie vaccinale et ne permettent pas de distinguer la virémie vaccinale d’une infection par un type sauvage du virus de la dengue.
3. Liste des effets indésirables
Les effets indésirables associés à Qdenga reportés dans les études cliniques et l’expérience post-autorisation sont présentés sous forme de tableau ci-dessous (voir ci-dessous).
Le profil de sécurité présenté ci-dessous est basé sur des données obtenues dans le cadre d’études cliniques contrôlées versus placebo et sur l’expérience post-autorisation. Une analyse groupée des études cliniques a inclus les données de 14 627 participants d’étude, âgés de 4 à 60 ans (13 839 enfants et 788 adultes), qui ont été vaccinés par Qdenga. Cela comprenait un sous-groupe de réactogénicité de 3 830 participants (3 042 enfants et 788 adultes).
Les effets indésirables signalés sont énumérés selon les catégories de fréquence suivantes :
- très fréquent : ≥ 1/10 ;
- fréquent : ≥ 1/100 à < 1/10 ;
- peu fréquent : ≥ 1/1 000 à < 1/100 ;
- rare : ≥ 1/10 000 à < 1/1 000 ;
- très rare : < 1/10 000 ;
- fréquence indéterminée : ne peut être estimée sur la base des données disponibles.
3.1. Effets indésirables issus des études cliniques (patients âgés de 4 à 60 ans) et de l’expérience post-autorisation (patients âgés de 4 ans et plus)
Infections et infestations
- Très fréquent : infection des voies aériennes supérieures 1.
- Fréquent : rhinopharyngite,Pharyngo-amygdalite 2.
- Peu fréquent : bronchite, rhinite.
Affections hématologiques et du système lymphatique
- Très rare Thrombopénie 3.
Affections du système immunitaire
- Fréquence indéterminée : réaction anaphylactique, dont choc anaphylactique 3.
Troubles du métabolisme et de la nutrition
- Très fréquent : diminution de l’appétit 4.
Affections psychiatriques
- Très fréquent : irritabilité 4.
Affections du système nerveux
- Très fréquent : céphalées, somnolence 4
- Peu fréquent : sensation vertigineuse.
Affections oculaires
- Fréquence indéterminée : Douleur oculaire 3.
Affections gastro-intestinales
- Peu fréquent : diarrhée, nausées, douleurs abdominales, vomissements.
Affections de la peau et du tissu sous-cutané
- Peu fréquent : éruption cutanée 5, prurit 6, urticaire.
- Rare : Pétéchies 3.
- Très rare : angiœdème.
Affections musculo-squelettiques et du tissu conjonctif
- Très fréquent : myalgies.
- Fréquent : arthalgies.
Troubles généraux et anomalies au site d’administration
- Très fréquent : douleur au site d’injection, érythème au site d’injection, malaise, asthénie, fièvre.
- Fréquent : gonflementau site d’injection, contusion au site d'injection 6, prurit au site d'injection 6, syndrome pseudo-grippal.
- Peu fréquent : hémorragie au site d'injection 6, fatigue 6, altération de la couleur au site d'injection 6.
2 : inclut la pharyngo-amygdalite et amygdalite ;
3 :Effet indésirable observé dans un contexte post-autorisation ;
4: observé chez les enfants âgés de moins de 6 ans dans les études cliniques ;
5 : inclut éruption cutanée, éruption cutanée virale, éruption maculopapuleuse, éruption prurigineuse ;
6 : rapporté chez les adultes dans des études cliniques.
3. 2. Population pédiatrique
Données pédiatriques chez des sujets âgés de 4 à 17 ans
Les données de sécurité groupées provenant des essais cliniques sont disponibles pour 13 839 enfants (9 210 âgés de 4 à 11 ans et 4 629 âgés de 12 à 17 ans). Cela comprend les données de réactogénicité recueillies auprès de 3 042 enfants (1 865 âgés de 4 à 11 ans et 1 177 âgés de 12 à 17 ans).
La fréquence, le type et la gravité des effets indésirables chez les enfants étaient largement cohérents avec ceux observés chez les adultes. Les réactions indésirables rapportées plus fréquemment chez les enfants que chez les adultes étaient la fièvre (11 % contre 3 %), l’infection des voies respiratoires supérieures (11 % contre 3 %), la rhinopharyngite (6 % contre 0,6 %), la pharyngo-amygdalite (2 % contre 0,3 %) et le syndrome grippal (1 % contre 0,1 %). Les réactions indésirables rapportées moins fréquemment chez les enfants que chez les adultes étaient l’érythème au site d’injection (2 % contre 27 %), les nausées (0,03 % contre 0,8 %) et l'arthralgie (0,03 % contre 1 %).
Les réactions suivantes ont été observées chez 357 enfants âgés de moins de 6 ans vaccinés avec Qdenga : diminution de l’appétit (17 %), somnolence (13 %) et irritabilité (12 %).
Données pédiatriques chez des sujets âgés de moins de 4 ans, c.-à-d. en dehors de l’indication d’âge.
La réactogénicité chez des sujets âgés de moins de 4 ans a été évaluée chez 78 sujets ayant reçu au moins une dose de Qdenga dont 13 sujets avaient reçu le schéma posologique de 2 doses indiquées. Les réactions rapportées très fréquemment étaient l’irritabilité (25 %), la fièvre (17 %), la douleur au site d’injection (17 %) et la perte d’appétit (15 %). La somnolence (8 %) et l’érythème au site d’injection (3 %) ont été fréquemment rapportés. Aucun gonflement au site d’injection n’a été observé chez les sujets âgés de moins de 4 ans.
4. Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Qdenga a une influence mineure sur l’aptitude à conduire des véhicules et à utiliser des machines.
5. Surdosage
Aucun cas de surdosage n’a été rapporté.
6. Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet :www.signalement-sante.gouv.fr.
Pharmacodynamie
Classe pharmacothérapeutique : Vaccins, vaccins viraux.
Code ATC : J07BX04.
1. Mécanisme d’action
Qdenga contient des virus vivants atténués de la dengue. Le principal mécanisme d’action de Qdenga consiste à se répliquer localement et à susciter des réponses immunitaires humorales et cellulaires contre les quatre sérotypes du virus de la dengue.
2. Efficacité clinique
L’efficacité clinique de Qdenga a été évaluée dans l’étude DEN-301, une étude pivot de phase III, en double aveugle, randomisée, contrôlée contre placebo, menée dans 5 pays d’Amérique latine (Brésil, Colombie, République dominicaine, Nicaragua, Panama) et 3 pays d’Asie (Sri Lanka, Thaïlande, Philippines). Un total de 20 099 enfants âgés de 4 à 16 ans ont été randomisés (rapport de 2:1) pour recevoir Qdenga ou le placebo, indépendamment d’une infection antérieure par la dengue.
L’efficacité a été évaluée en utilisant la surveillance active pendant toute la durée de l’étude. Tout sujet présentant une maladie fébrile (définie comme une fièvre ≥ 38 °C pendant 2 jours sur 3 jours consécutifs) a dû se rendre au centre d’étude pour une évaluation de la fièvre due à la dengue par l’investigateur. Cette exigence a été rappelée aux sujets/tuteurs au moins une fois par semaine pour maximiser la détection de tous les cas symptomatiques de dengue confirmée par virologie (DCV). Les épisodes fébriles ont été confirmés par un test RT-PCR quantitatif validé, afin de détecter les sérotypes spécifiques de la dengue.
Données d’efficacité clinique pour les sujets âgés de 4 à 16 ans
Les résultats d’efficacité du vaccin (VE, vaccine efficacy), selon le critère d’évaluation principal (fièvre associée à la DCV survenant de 30 jours à 12 mois après la deuxième vaccination) sont présentés dans le Tableau 1. L’âge moyen de la population per protocole de l’essai était de 9,6 ans (écart-type de 3,5 ans) avec 12,7 % des sujets dans la tranche d’âge 4 - 5 ans, 55,2 % dans la tranche d’âge 6 - 11 ans et 32,1 % dans la tranche d’âge 12 - 16 ans. Sur ceux-ci, 46,5 % étaient en Asie et 53,5 % étaient en Amérique latine, 49,5 % étaient de sexe féminin et 50,5 % étaient de sexe masculin. Le statut sérologique de la dengue à l’inclusion (avant la première injection) a été évalué chez tous les sujets par un test de microneutralisation (TMN50) pour permettre l’évaluation de l’efficacité du vaccin (VE) en fonction du statut sérologique de référence. Le taux de séronégativité de la dengue de référence pour l’ensemble de la population per protocole était de 27,7 %.
Tableau 1 : Efficacité du vaccin dans la prévention de la fièvre associée à la DCV causée par tout sérotype, de 30 jours à 12 mois après la deuxième vaccination dans l’étude DEN-301 (ensemble per protocole) a
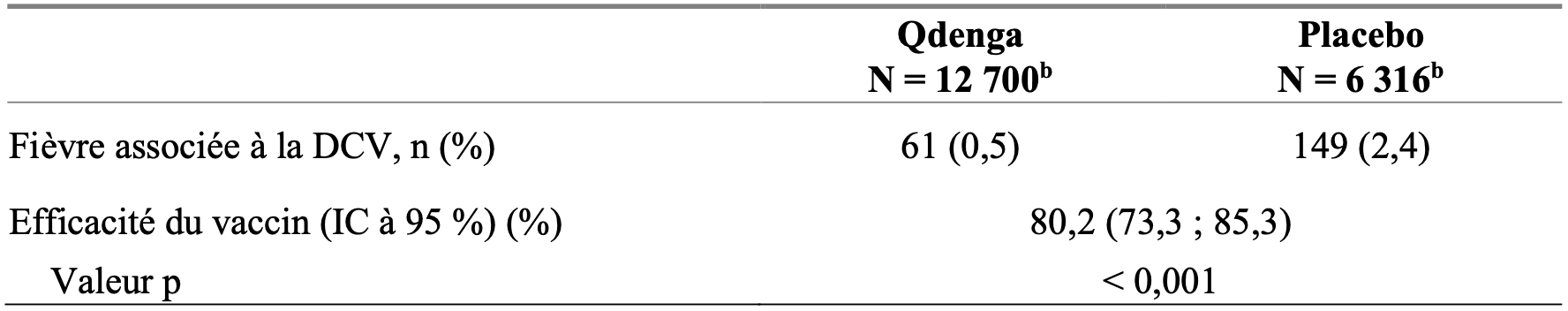
n : nombre de sujets présentant une fiévre ;
DCV : dengue confirmée par virologie ;
a : l’analyse principale des données d’efficacité se basait sur la population per protocole, qui comprenait tous les sujets randomisés n’ayant pas présenté de déviations majeures du protocole, y compris ceux ne recevant pas les deux doses de la bonne affectation de Qdenga ou le placebo ;
b : nombre de sujets évalués.
Les résultats de VE selon les critères d’évaluation secondaires, la prévention de l’hospitalisation due à une fièvre associée à la DCV, la prévention de la fièvre associée à la DCV par statut sérologique, par sérotype et prévention de la fièvre associée à la DCV sévère, sont présentés dans le Tableau 2. Pour la fièvre associée à la DCV sévère, deux types de critères d’évaluation ont été pris en compte : cas de DCV cliniquement sévères et cas de DCV, qui satisfont aux critères de la dengue hémorragique (DH) de l’OMS de 1997. Les critères utilisés dans l’essai DEN-301 pour l’évaluation de la gravité de la DCV par un « Comité indépendant de détermination de la gravité de cas de dengue » (DCAC, Dengue Case severity Adjudication Committee) étaient basés sur les directives de l’OMS de 2009. Le DCAC a évalué tous les cas d’hospitalisation due à la DCV en utilisant les critères prédéfinis qui comprenaient une évaluation des anomalies de saignement, de la fuite plasmatique, de la fonction hépatique, de la fonction rénale, de la fonction cardiaque, du système nerveux central et le choc. Dans l'essai DEN- 301, les cas de DCV répondant aux critères de l’OMS de 1997 pour la DH ont été identifiés à l’aide d’un algorithme programmé, c.-à-d., sans appliquer d’évaluation médicale. En règle générale, les critères incluaient la présence de fièvre durant 2 à 7 jours, les tendances hémorragiques, la thrombocytopénie et des signes de fuite plasmatique.
Tableau 2 : Efficacité du vaccin dans la prévention de l’hospitalisation due à une fièvre associée à la DCV, la fièvre associée à la DCV par sérotype de dengue, la fièvre associée à la DCV selon le statut sérologique de la dengue à l’inclusion, et des formes sévères de la dengue, de 30 jours à 18 mois après la deuxième vaccination dans l’étude DEN-301 (population per protocole)
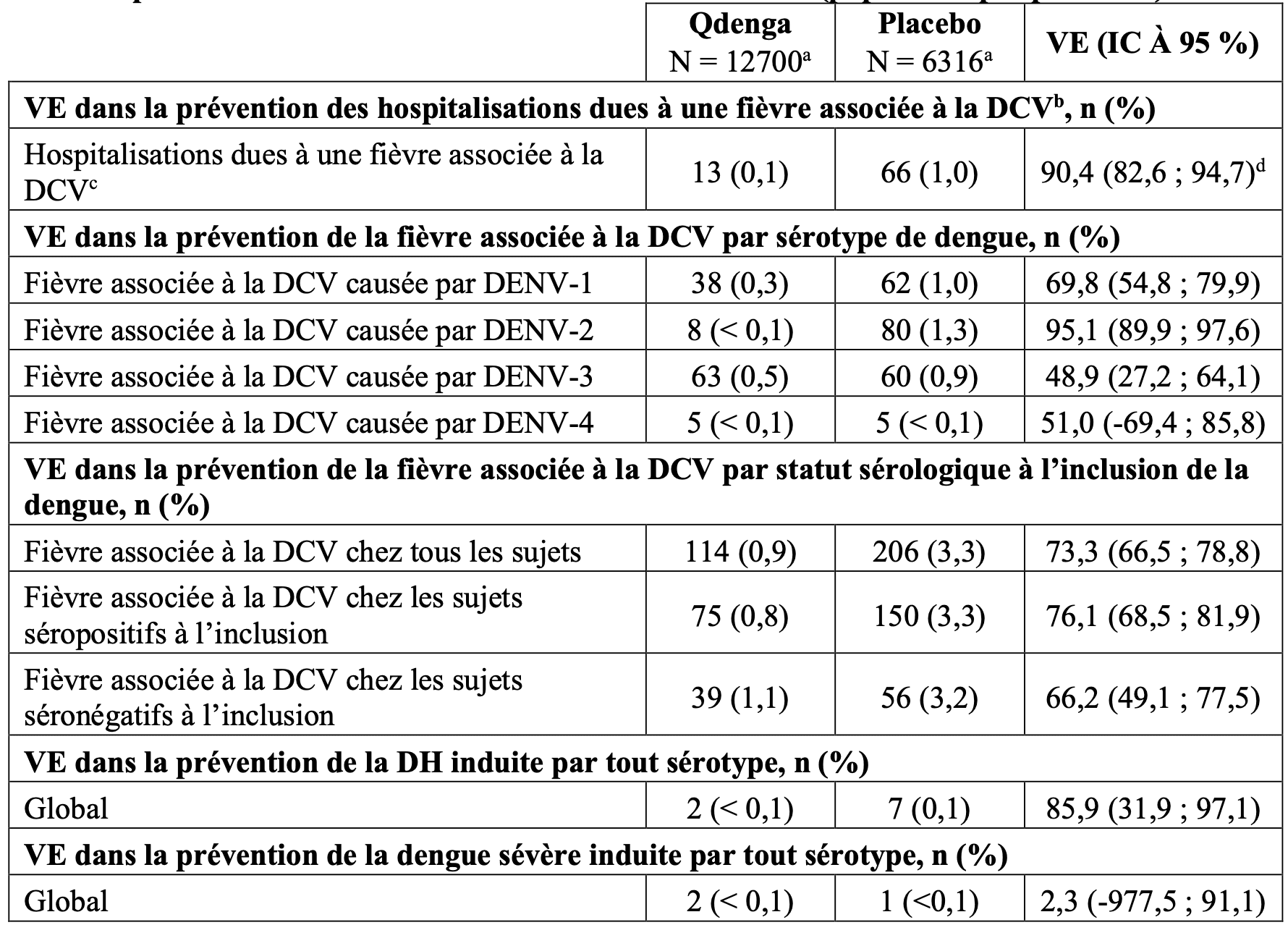
IC : intervalle de confiance ;
n : nombre de sujets ;
DCV : dengue confirmée par virologie (Dengue confirmée virologiquement) ;
DENV : sérotype du virus de la dengue ;
a : Nombre de sujets évalués ;
b : Principal critére d’évaluation secondaire ;
c : La plupart des cas observés sont dus au DENV-2 (0 cas dans le bras Qdenga et 46 cas dans le bras placebo)
d : Valeur p < 0,001.
Une apparition précoce de la protection a été observée entre la première et la deuxième injection avec une VE exploratoire de 81,1 % (IC à 95 % : 64,1 % ; 90,0 %) contre la fièvre associée à la DCV causée par tous les sérotypes confondus.
Protection à long terme
Dans l’étude DEN-301, plusieurs analyses exploratoires ont été menées pour estimer la protection à long terme de la première dose à 4,5 ans après la deuxième dose (Tableau 3).
Tableau 3 : Efficacité du vaccin dans la prévention de la fièvre associée à la DCV et des hospitalisations totales, en fonction du statut sérologique à l’inclusion pour la dengue, et contre les sérotypes individuels en fonction du statut sérologique à l’inclusion, de la première dose à 54 mois après la deuxième dose dans l’étude DEN-301 (population de sécurité d’emploi).
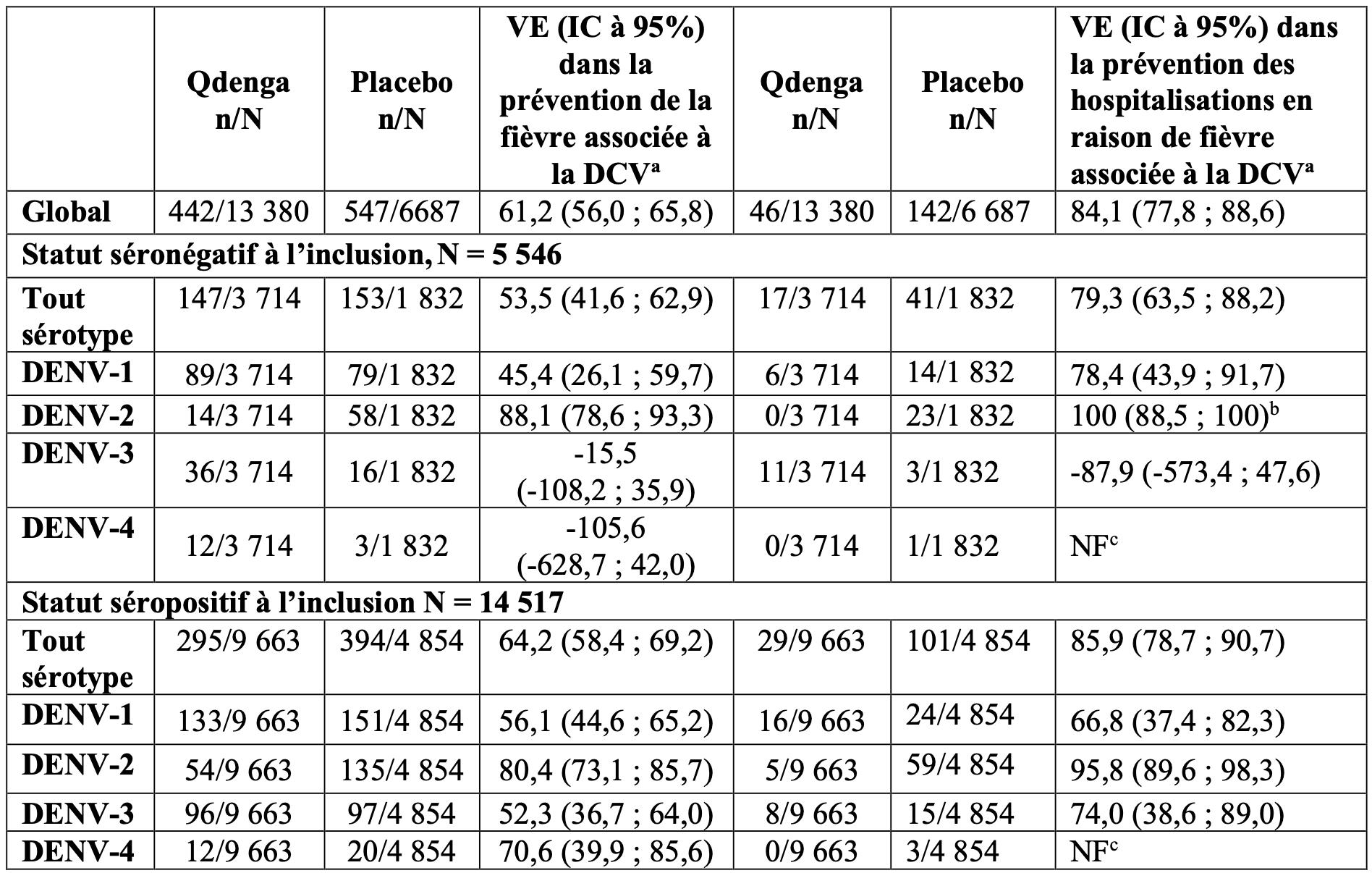
IC : intervalle de confiance ;
DCV : dengue confirmée par virologie ;
n : nombre total de sujets ;
N : nombre total de sujets évalués ;
NF : non fourni ;
a : analyses exploratoires : l’étude n’a pas été conc?ue pour démontrer une différence entre le groupe vaccin et le groupe placebo ;
b : approximation à l’aide d’un IC unilatéral à 95% ;
c : l’estimation de la VE n’est pas fournie car moins de 6 cas ont été observés pour le TVD et le placebo.
En outre, la VE dans la prévention de la DH causée par tout sérotype était de 70,0 % (IC à 95 % : 31,5 % ; 86,9 %) et dans la prévention des cas cliniquement sévères de la DCV causée par tout sérotype était de 70,2 % (IC à 95 % : -24,7 % ; 92,9 %).
La VE dans la prévention de la DCV a été démontrée pour les quatre sérotypes chez les sujets séropositifs pour la dengue à l’inclusion. Chez les sujets séronégatifs à l’inclusion, la VE a été démontrée pour DENV-1 et DENV-2, mais non suggérée pour DENV-3 et n’a pas pu être démontrée pour DENV-4 en raison d’une plus faible incidence de cas (Tableau 3).
Une analyse année par année jusqu’à quatre ans et demi après la deuxième dose a été effectuée (Tableau 4).
Tableau 4 : Efficacité du vaccin dans la prévention de la fiévre associée à la DCV et de l’hospitalisation globale et en fonction du statut sérologique pour la dengue à l’inclusion, par intervalles annuels de 30 jours aprés la deuxiéme dose dans l’étude DEN-301 (population per protocole).
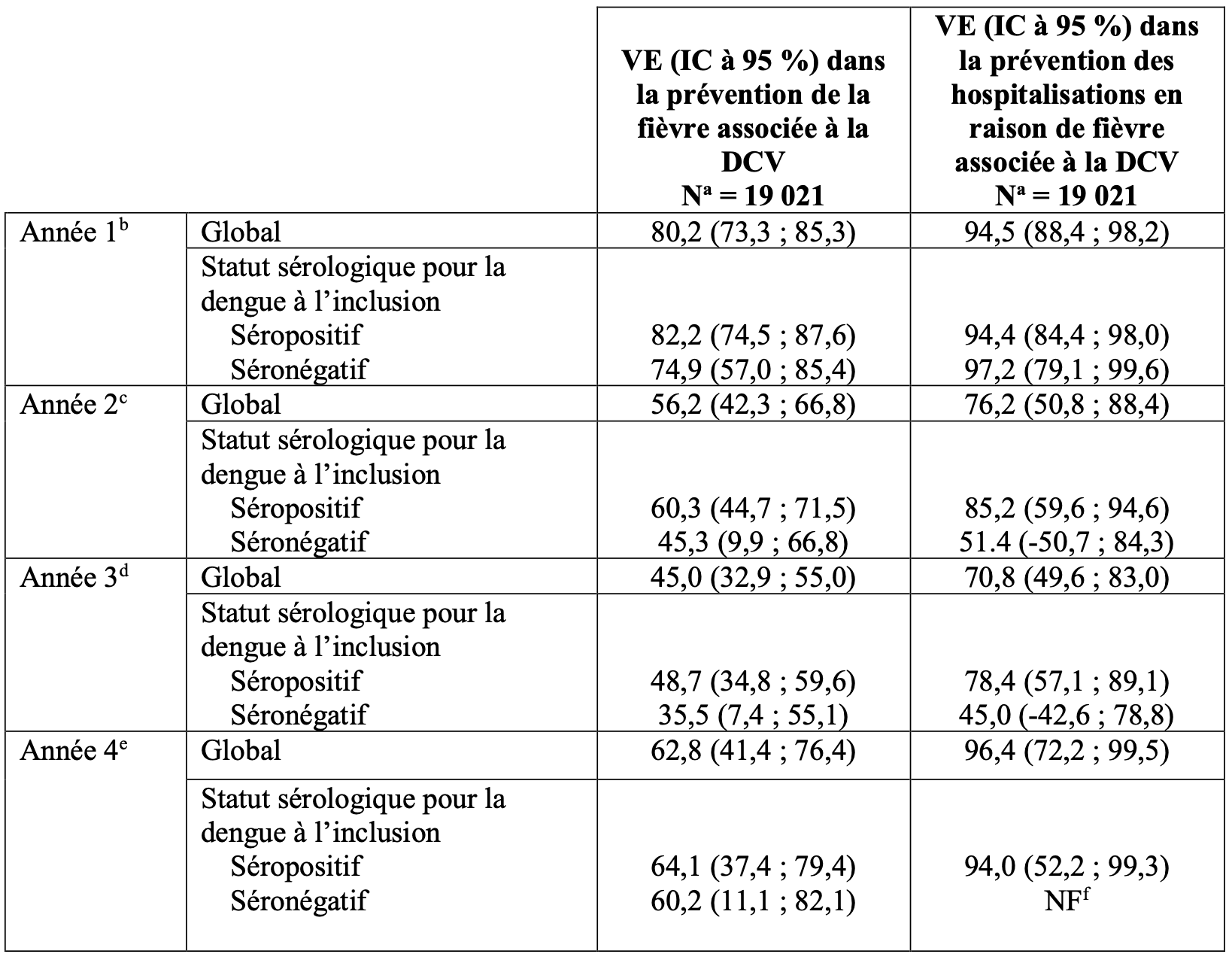
IC : intervalle de confiance ;
DCV : dengue confirmée par virologie ;
NF : non fourni ;
N : nombre total de sujets dans l’étude par groupe d’analyse ;
a le nombre de sujets évalués chaque année est différent ;
b : l’année 1 fait référence à 11 mois à compter 30 jours aprés la deuxiéme dose ;
c : l’année 2 fait référence à la période allant de 13 à 24 mois aprés la deuxiéme dose ;
d : d’année 3 fait référence à la période allant de 25 à 36 mois aprés la deuxiéme dose ;
e : l’année 4 fait référence à la période allant de 37 à 48 mois aprés la deuxiéme dose :
f : l’estimation de la VE n’est pas fournie car moins de 6 cas ont été observés pour le TVD et le placebo.
Efficacité clinique pour les sujets à partir de 17 ans
Aucune étude d’efficacité clinique n’a été menée chez les sujets à partir de 17 ans. L’efficacité de Qdenga chez les sujets à partir de 17 ans est déduite de l’efficacité clinique chez les sujets âgés de 4 à 16 ans par extrapolation des données d’immunogénicité (voir ci-dessous).
Immunogénicité
En l’absence de corrélats de protection pour la dengue, la pertinence clinique des données d’immunogénicité n’est pas encore complètement établie.
Données d’immunogénicité pour les sujets âgés de 4 à 16 ans dans les zones endémiques
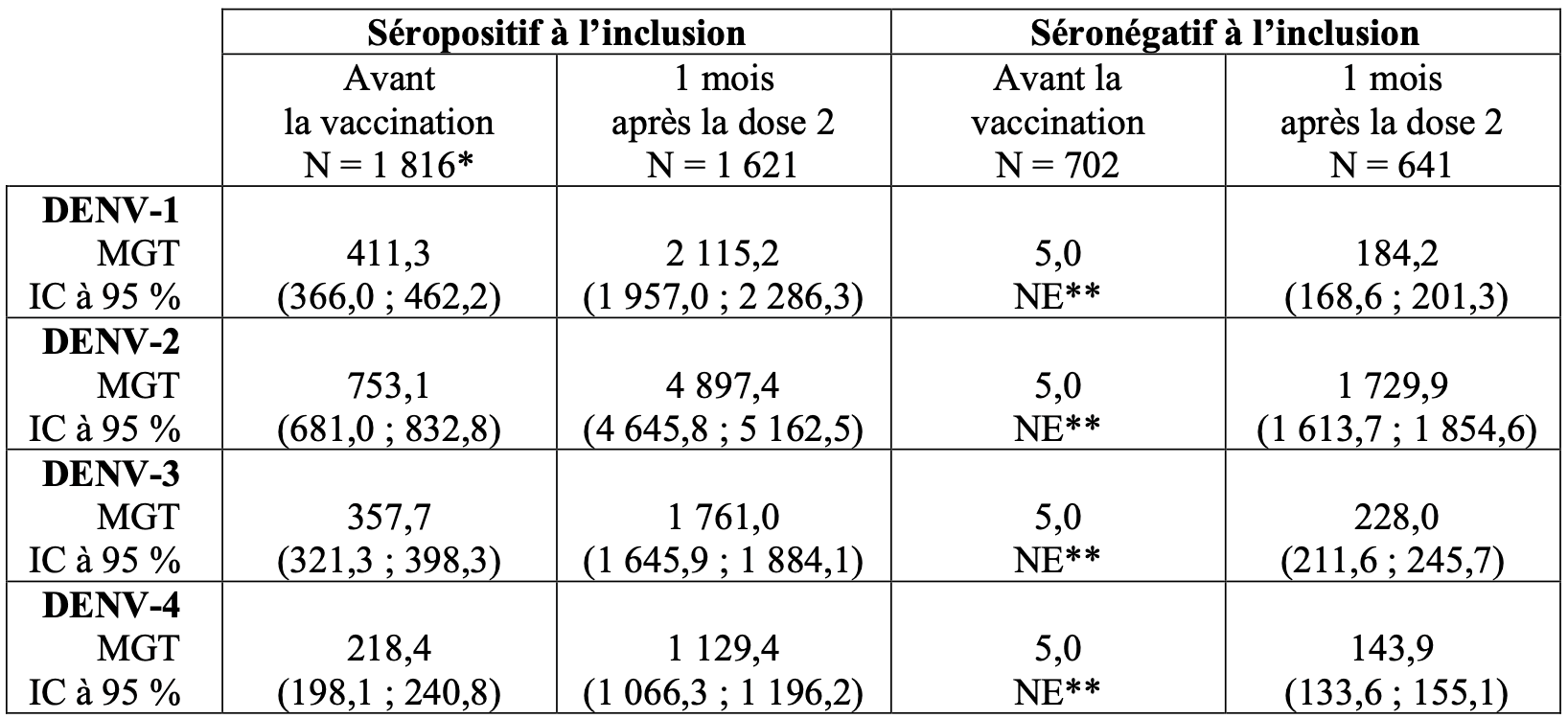
Les moyennes géométriques des titres (MGTs) en fonction du statut sérologique pour la dengue à l’inclusion chez les sujets âgés de 4 à 16 ans de l’étude DEN-301 sont présentées dans le Tableau 5.
Tableau 5 : Immunogénicité en fonction du statut sérologique pour la dengue à l’inclusion dans l’étude DEN-301 (ensemble per protocole pour l’analyse de l’immunogénicité) a
DENV : virus de la dengue ;
MGT : moyenne géométrique du titre ;
IC : intervalle de confiance ;
NE : non estimé ;
a : le sous-groupe d’immunogénicité était un sous-groupe de sujets sélectionnés de fac?on aléatoire et l’ensemble per protocole pour l’analyse de l’immunogénicité correspondait au groupe de sujets de ce sous-groupe, qui appartenait également à la population per protocole ;
* : pour DENV-2 et DENV-3 : N = 1 815 ;
** : tous les sujets avaient des valeurs MGT inférieures à la LID (Limite Inférieure de Détection) (10) et ont par conséquent été rapportés comme 5 sans valeurs d’IC.
Données d’immunogénicité pour les sujets âgés de 18 à 60 ans dans les zones non endémiques
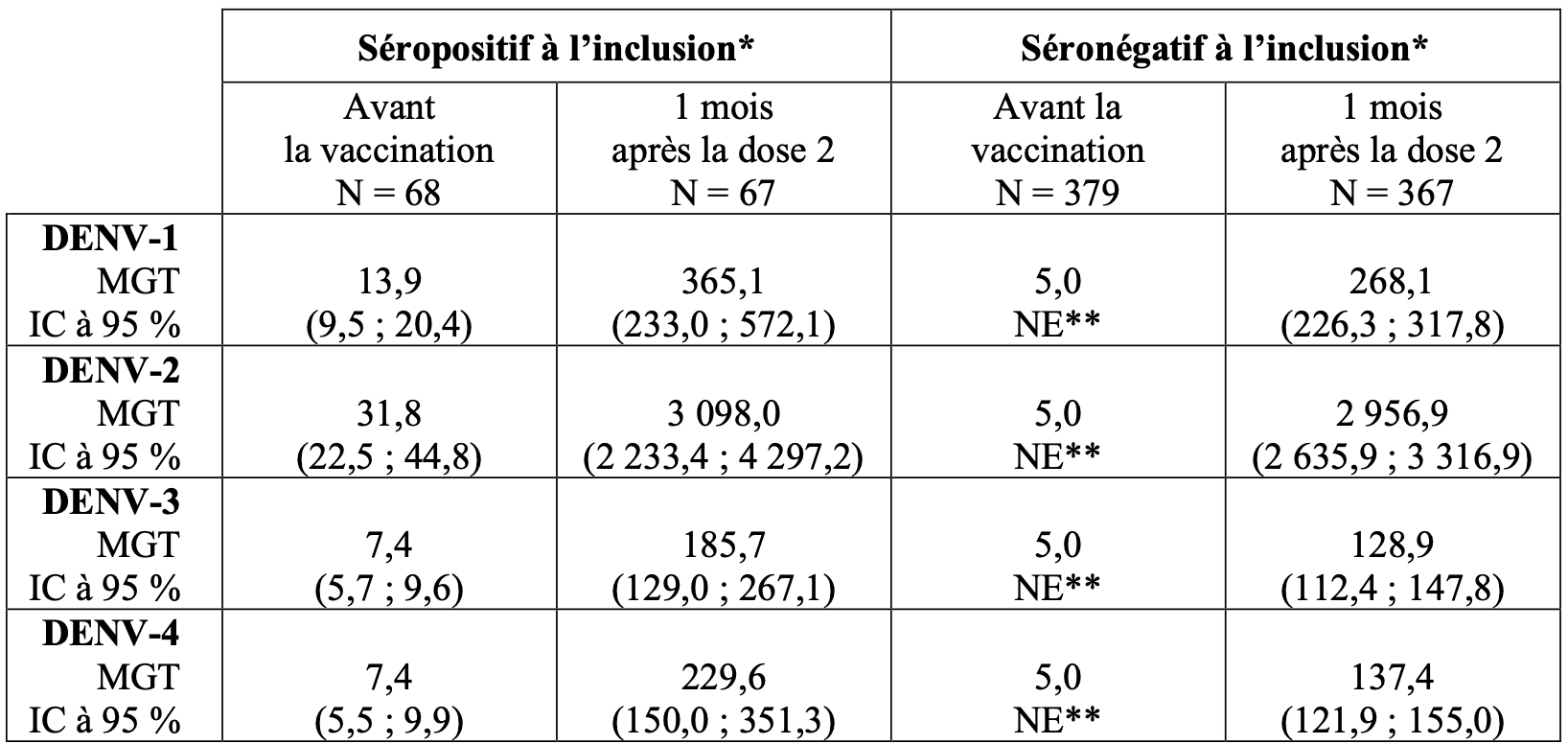
L’immunogénicité de Qdenga chez les adultes âgés de 18 à 60 ans a été évaluée dans DEN-304, une étude de phase 3 en double aveugle, randomisée, contrôlée contre placebo, menée dans un pays non endémique (États-Unis). Les MGT après la dose 2 sont présentées dans le Tableau 6.
Tableau 6 : MGT pour les anticorps neutralisants de la dengue dans l’étude DEN-304 (ensemble per protocole)

DENV : virus de la dengue ;
MGT : moyenne géométrique du titre ;
IC : intervalle de confiance ;
NE : non estimé ;
* : données groupées du vaccin tétravalent contre la dengue, lots 1, 2 et 3 ;
** : tous les sujets avaient des valeurs MGT inférieures à la LID (10) et ont par conséquent été rapportés comme 5 sans valeurs d’IC.
L’extrapolation des données d’efficacité est fondée sur les données d’immunogénicité et les résultats d’une analyse de non-infériorité, comparant les MGT post-vaccinales dans les populations séronégatives pour la dengue à l’inclusion des études DEN-301 et DEN-304 (Tableau 7). La protection contre la dengue est attendue chez les adultes bien que l’efficacité actuelle par rapport à celle observée chez les enfants et les adolescents soit inconnue.
Tableau 7 : Rapports des MGT entre les sujets séronégatifs pour la dengue à l’inclusion dans les études DEN-301 (4 à 16 ans) et DEN-304 (18 à 60 ans) (population per protocole pour l’analyse de l’immunogénicité)


MGT : moyenne géométrique du titre ;
IC : intervalle de confiance ;
m : mois ;
* non-infériorité : limite supérieure de l’IC à 95 % inférieure à 2,0.
Persistance à long terme des anticorps.
La persistance à long terme des anticorps neutralisants a été démontrée dans l’étude DEN-301, dont les titres restent bien au-dessus des taux avant la vaccination pour les quatre sérotypes, jusqu’à 51 mois après la première dose.
Administration concomitante avec le vaccin 9vHPV
Dans l’étude DEN308 incluant environ 300 sujets âgés de 9 à 14 ans ayant reçu une administration concomitante de Qdenga et d’un vaccin nonavalent contre le HPV, aucun effet n’a été observé sur la réponse immunitaire au vaccin contre le HPV. L’étude a évalué uniquement la coadministration des premières doses de Qdenga et du vaccin nonavalent contre le HPV. La non-infériorité de la réponse immunitaire de Qdenga, lorsque Qdenga et le vaccin nonavalent contre le HPV étaient coadministrés, n’a pas été évaluée directement dans l’étude. Parmi la population de l’étude séronégative pour la dengue, les réponses des anticorps contre la dengue après la coadministration étaient du même ordre de grandeur que celles observées lors de l’étude de phase 3 (DEN301) où l’efficacité contre la DCV et la DCV nécessitant une hospitalisation a été démontrée.
Conservation
Durée de conservation : 18 mois.
À conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler.
À conserver dans l’emballage d’origine.
Après reconstitution avec le solvant fourni, Qdenga doit être utilisé immédiatement.
Si le produit n’est pas utilisé immédiatement, Qdenga doit être utilisé dans les 2 heures.
Les stabilités chimique et physique en cours d’utilisation ont été démontrées pendant 2 heures à température ambiante (jusqu’à 32,5 °C) à partir de la reconstitution du flacon de vaccin. Après cette période, le vaccin doit être jeté.
Ne pas le remettre au réfrigérateur.
D’un point de vue microbiologique, Qdenga doit être utilisé immédiatement. S’il n’est pas utilisé immédiatement, la durée et les conditions de conservation sont de la responsabilité de l’utilisateur.
Manipulation
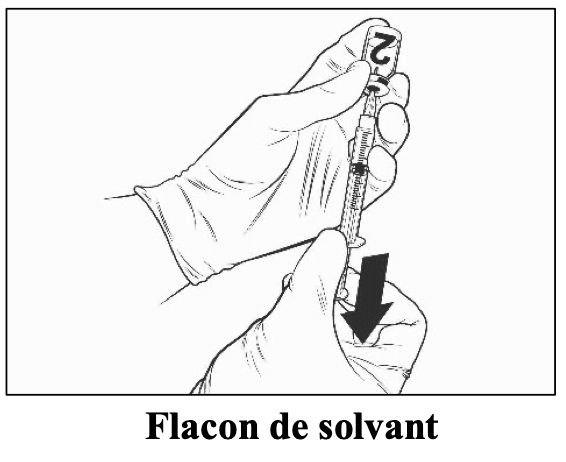
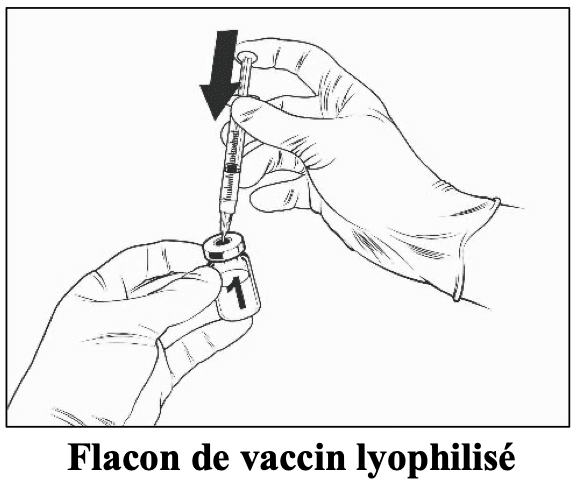
Instructions pour la reconstitution du vaccin avec le solvant présenté en flacon
Qdenga est un vaccin à deux composants comprenant un flacon contenant le vaccin lyophilisé et un flacon contenant le solvant. Le vaccin lyophilisé doit être reconstitué avec le solvant avant l’administration.
Utilisez uniquement des seringues stériles pour la reconstitution et l’injection de Qdenga. Qdenga ne doit pas être mélangé à d’autres vaccins dans la même seringue..
Pour reconstituer Qdenga, utilisez uniquement le solvant (solution de chlorure de sodium à 0,22 %) fourni avec le vaccin car il est dépourvu d’agent de conservation et d’autres substances antivirales. Le contact avec des agents de conservation, des antiseptiques, des détergents et d’autres substances antivirales doit être évité, car ils peuvent désactiver le vaccin.
Sorter les flacons de vaccin et de solvant du réfrigérateur.
 |
|
 |
|
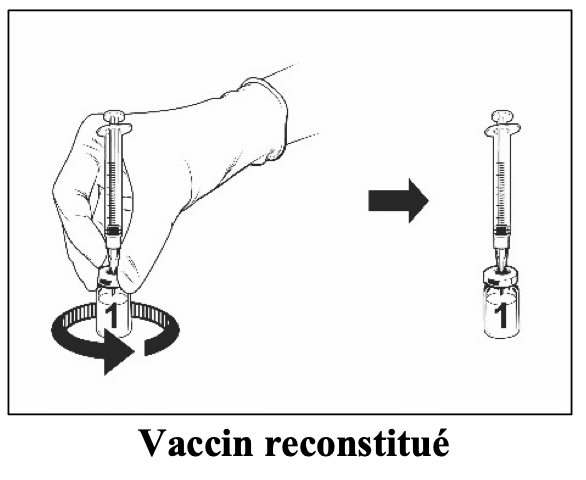 |
|
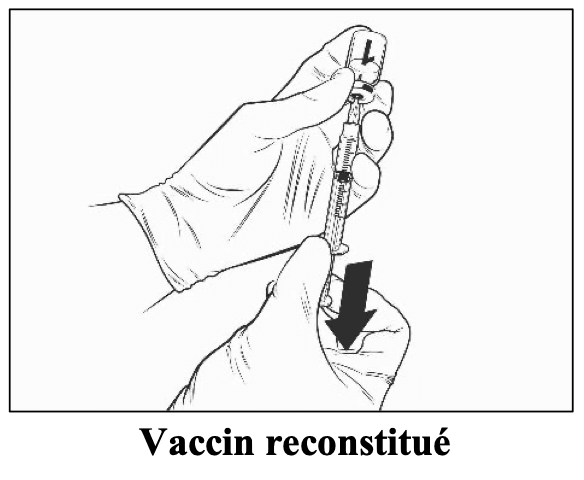
Après reconstitution, la solution obtenue doit être limpide, incolore à jaune pâle et pratiquement exempte de particules étrangères. Jetez le vaccin si des particules sont présentes et/ou s’il paraît décoloré.
 |
|
Qdenga doit être administré immédiatement après la reconstitution. La stabilité chimique et physique lors de l’utilisation a été démontrée pendant 2 heures à température ambiante (jusqu’à 32,5°C) à partir du moment de la reconstitution du flacon de vaccin. Au-delà de cette période, le vaccin doit être jeté. Ne pas le remettre au réfrigérateur. D’un point de vue microbiologique, Qdenga doit être utilisé immédiatement. S’il n’est pas utilisé immédiatement, la durée et les conditions de conservation sont de la responsabilité de l’utilisateur.
Instructions pour la reconstitution du vaccin avec le solvant présenté en seringue pré-remplie
Qdenga est un vaccin à deux composants qui consiste en un flacon contenant un vaccin lyophilisé et un solvant fourni dans une seringue pré-remplie. Le vaccin lyophilisé doit être reconstitué avec le solvant avant l’administration.
Qdenga ne doit pas être mélangé à d’autres vaccins dans la même seringue.
Pour reconstituer Qdenga, utilisez uniquement le solvant (solution de chlorure de sodium à 0,22 %) dans la seringue pré-remplie fournie avec le vaccin car il est dépourvu d’agent de conservation et d’autres substances antivirales. Le contact avec des agents de conservation, des antiseptiques, des détergents et d’autres substances antivirales doit être évité, car ils peuvent désactiver le vaccin.
Sorter le flacon de vaccin et la seringue pré-remplie de solvant du réfrigérateur.
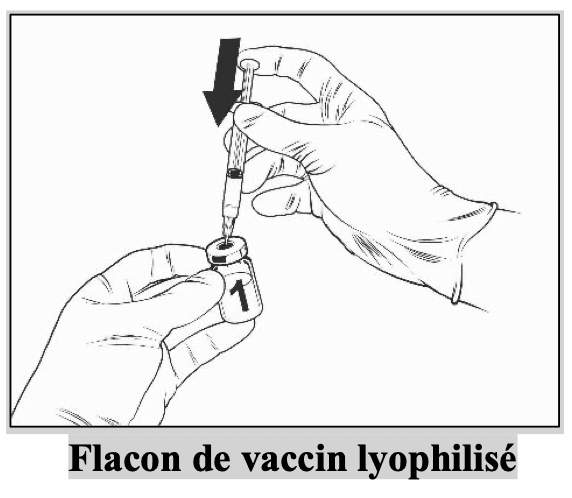 |
|
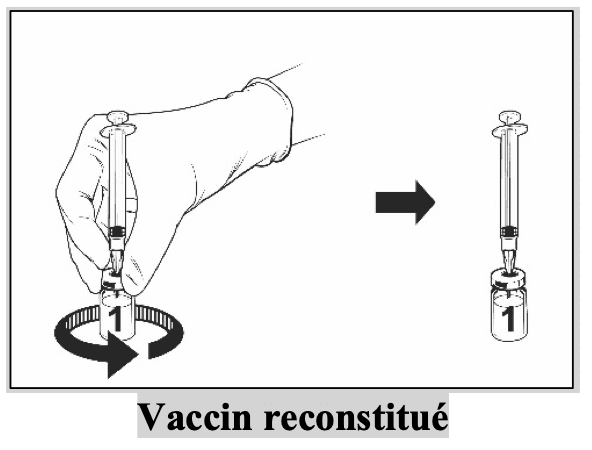 |
|
Après reconstitution, la solution obtenue doit être limpide, incolore à jaune pâle et pratiquement exempte de particules étrangères. Jetez le vaccin si des particules sont présentes et/ou s’il paraît décoloré.
 |
|
Qdenga doit être administré immédiatement après la reconstitution. La stabilité chimique et physique lors de l’utilisation a été démontrée pendant 2 heures à température ambiante (jusqu’à 32,5°C) à partir du moment de la reconstitution du flacon de vaccin. Au-delà de cette période, le vaccin doit être jeté.
Ne pas le remettre au réfrigérateur. D’un point de vue microbiologique, Qdenga doit être utilisé immédiatement. S’il n’est pas utilisé immédiatement, la durée et les conditions de conservation sont de la responsabilité de l’utilisateur.
L'administration du vaccin doit être consignée par le médecin sur le carnet de vaccination ou de santé avec le numéro de lot. Il peut aussi être inscrit par le patient ou son médecin sur uncarnet de vaccination électronique.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Autres informations
Données de sécurité préclinique
Les données de sécurité non cliniques issues des études conventionnelles de tolérance locale d’une seule dose, de toxicologie en administration répétée, et de toxicité sur la reproduction et le développement, n’ont pas révélé de risque particulier pour l’homme. Dans une étude de distribution et d’excrétion, aucune excrétion de l’ARN de Qdenga n’a été observée dans les fèces et l’urine, confirmant un faible risque d’excrétion du vaccin dans l’environnement ou de transmission depuis les sujets vaccinés. Une étude de neurovirulence montre que Qdenga n’est pas neurotoxique.
Bien qu’aucun danger important n’ait été identifié, la pertinence des études de toxicité sur la reproduction est limitée car les lapins ne sont pas sensibles à l’infection par le virus de la dengue.
Remboursement
Prix libre, médicament non remboursable.