MENVEO
Laboratoire : GSK Vaccines
Depuis le 28 juillet 2025, ce vaccin est remboursé à 65 % par l'assurance maladie dans le cadre des recommandations vaccinales générales (vaccination des 11-24 ans), la vaccination étant déjà remboursée pour les personnes à risque d'infection invasive à méningocoque âgées de deux ans et plus.
De nouvelles recommandations sur le rattrapage vaccinal ont été publiées en mars 2025 en raison d'une recrudescence des infections invasives à méningocoques : un rattrapage vaccinal jusqu’à 5 ans est recommandé chez les enfants n’ayant pas été vaccinés contre les sérogroupes ACWY.
Le 27 novembre 2024, la Commission européenne approuve une présentation monodose et prête à l'emploi de ce vaccin, sans besoin de le reconstituer à partir d'un lyophilisat.
Description
Vaccin méningococcique polyosidique conjugué quadrivalent contre les sérogroupes A, C, W et Y (conjugué à la protéine CRM 197).
Forme et Présentation
Formes pharmaceutiques
Ce vaccin existe en 2 formes :
- Menveo, poudre et solution pour solution injectable
- Menveo, solution injectable prête à l'emploi
1. Poudre et solution pour solution injectable.
La poudre est un agglomérat blanc à blanc cassé.
La solution est une solution limpide incolore.
Nature et contenu de l'emballage extérieur
- Poudre dans un flacon (verre de type I) muni d’un bouchon (caoutchouc butyle) et solution en flacon (verre de type I) muni d’un bouchon (caoutchouc butyle).
Boîte d’une dose (2 flacons), cinq doses (10 flacons) ou dix doses (20 flacons).
2. Solution injectable prête à l'emploi
La solution est une solution limpide incolore.
- Solution dans un flacon (verre de type I) avec un bouchon en caoutchouc bromobutyle revêtu d’éthylène tétrafluoroéthylène (ETFE) et un bouchon rose amovible.
1 dose (1 flacon) ou 10 doses (10 flacons) par boîte. Chaque flacon contient une dose de 0,5 mL.
Toutes les présentations peuvent ne pas être commercialisées.
Composition
Une dose (0,5 mL de vaccin reconstitué) contient :
1. Antigènes
- Initialement contenu dans la poudre :
- Oligoside de Neisseira meningitidis du groupe A : 10 microgrammes
Conjugué à la protéine CRM197 de Corynebacterium diphtheriae : 16,7 - 33,3 microgrammes - Initialement contenu dans la solution :
- Oligoside de Neisseira meningitidis du groupe C : 5 microgrammes
Conjugué à la protéine CRM197 de Corynebacterium diphtheria e : 7,1 - 12,5 microgrammes - Oligoside de Neisseira meningitidis du groupe W-135 : 5 microgrammes
Conjugué à la protéine CRM197 de Corynebacterium diphtheriae : 3,3 - 8,3 microgrammes - Oligoside de Neisseira meningitidis du groupe Y : 5 microgrammes
Conjugué à la protéine CRM197 de Corynebacterium diphtheriae : 5,6 - 10,0 microgrammes
2. Excipients
Poudre (pour la forme non prête à l'emploi)
- Saccharose
- Phosphate monopotassique
Solution
- Phosphate monosodique monohydraté
- Phosphate disodique dihydraté
- Chlorure de sodium
- Eau pour préparations injectables
Indications
Menveo est indiqué pour l’immunisation active des enfants (à partir de 2 ans), des adolescents et des adultes à risque d’exposition à Neisseria meningitidis des sérogroupes A, C, W-135 et Y, pour prévenir la maladie invasive.
L’utilisation de ce vaccin doit être effectuée en suivant les recommandations officielles.
Posologie
1. Enfants (âgés de plus de 2 ans), adolescents et adultes
Menveo doit être administré en une dose unique (0,5 mL).
Afin d'assurer un taux optimal d'anticorps dirigés contre tous les sérogroupes vaccinaux, la primovaccination par Menveo doit être terminée un mois avant tout risque d'exposition à Neisseria meningitidis des groupes A, C, W-135 et Y. Des anticorps bactéricides (hSBA ≥ 1:8) ont été observés chez au moins 64 % des sujets une semaine après la vaccination (voir rubrique "Pharmacodynamie" pour les données d'immuniogénicité par sérogroupe).
2. Personnes âgées
Il existe peu de données chez les sujets âgés de 56 à 65 ans et il n’existe pas de données chez les sujets de plus de 65 ans.
3. Vaccination de rappel
Les données de persistance des anticorps à long terme après la vaccination par Menveo sont disponibles pour une durée de 5 ans après la vaccination (voir rubriques "Mises en garde spéciales et précautions d'emploi" et "Pharmacodynamie").
Menveo peut être administré en dose de rappel chez des sujets ayant précédemment reçu une primovaccination par Menveo, un autre vaccin méningococcique conjugué ou un vaccin polysaccharidique méningococcique non conjugué. La nécessité d'une dose de rappel et sa date d'administration chez des sujets précédemment vaccinés par Menveo doivent être définies en fonction des recommandations nationales.
4. Population pédiatrique (âgée de moins de 2 ans)
La sécurité et l'efficacité de Menveo chez les enfants âgés de moins de 2 ans n'ont pas encore été établies. les données actuellement disponibles sont décrites à la rubrique "Pharmacodynamie" mais aucune recommandation sur la posologie ne peut être donnée.
Mode d'administration
Menveo est administré par injection intramusculaire de préférence dans le muscle deltoïde.
Il ne doit pas être administré par voie intraveineuse, sous-cutanée ou intradermique.
Des sites d’injections distincts doivent être utilisés si plusieurs vaccins sont administrés en même temps.
Pour les instructions concernant la reconstitution du médicament avant l’administration, voir la rubrique "Manipulation".
Contre-indications
Hypersensibilité à la substance active ou à un des excipients, mentionnés à la rubrique Composition, y compris l’anatoxine diphtérique (CRM197), ou une réaction ayant menacé le pronostic vital après une injection d’un vaccin contenant des composants semblables (voir rubrique "Mises en garde et précautions d'emploi").
Comme pour les autres vaccins, l’administration de Menveo doit être différée chez les sujets présentant une maladie fébrile aiguë sévère. La présence d’une infection mineure n’est pas une contre-indication.
Mises en garde et précautions d'emploi
Avant l’injection de tout vaccin, la personne responsable de l’injection doit prendre toutes les précautions nécessaires pour la prévention d’une réaction allergique ou toute autre réaction notamment en évaluant de manière approfondie les antécédents médicaux et l’état de santé actuel. Comme pour tous les vaccins injectables, il est indispensable de toujours disposer d’un traitement médical approprié et d’assurer une surveillance pour le cas rare où surviendrait une réaction anaphylactique suivant l’administration du vaccin.
Des réactions en rapport avec l'anxiété, y compris des réactions vaso-vagales (syncopes), de l'hyperventilation ou des réactions en rapport avec le stress peuvent survenir lors de la vaccination comme réaction psychogène à l'injection avec une aiguille. Il est important que des mesures soient mises en place afin d'éviter toute blessure en cas d'évanouissement.
Menveo ne doit, en aucun cas, être administré par voie intraveineuse.
Menveo ne protège pas contre les infections causées par tout autre sérogroupe de N. meningitidis non présent dans le vaccin.
Comme pour tous les vaccins, une réponse immunitaire protectrice peut ne pas être obtenue chez tous les sujets vaccinés (voir rubrique "Pharmacodynamie").
Les études avec Menveo ont montré une décroissance des titres d’anticorps bactéricides sériques anti sérogroupe A lorsque du complément humain est utilisé lors du dosage (hSBA) (voir rubrique "Pharmacodynamie"). La pertinence clinique de la décroissance des titres d’anticorps hSBA du sérogroupe A est inconnue. Si un sujet est considéré comme particulièrement à risque d'exposition au sérogroupe A (Men A) et a reçu une dose de Menveo plus d'un an avant environ, l'administration d'une dose de rappel peut être envisagée.
Il n'existe pas de données disponibles sur l’utilisation du vaccin en prophylaxie post-exposition.
Chez les sujets immunodéprimés, la vaccination pourrait ne pas entraîner une réponse en anticorps protecteurs suffisante. Bien que l’infection par le virus de l’immunodéficience humaine (VIH) ne soit pas une contre-indication, Menveo n’a pas été évalué spécifiquement chez les personnes immunodéprimées. Les sujets présentant un déficit en fractions du complément et les sujets présentant une asplénie fonctionnelle ou anatomique pourraient ne pas développer une réponse immunitaire aux vaccins méningococciques conjugués des sérogroupes A, C, W-135 et Y.
Les personnes ayant des déficites héréditaires du complément (par exemple les déficits en C3 et C5) et les personnes recevant un traitement inhibiteur de l'activation de la fraction terminale du complément ( par exemple, l'éculizumab) ont un risque accru de maladie invasive due à Neisseiria meningitidis des groupes A, C, W-135 et Y, après avoir développé des anticorps après vaccination par Menveo.
Menveo n’a pas été évalué chez les personnes ayant une thrombocytopénie, des troubles de la coagulation ou sous traitement anticoagulant, en raison du risque d’hématome. Le rapport risque-bénéfice pour les personnes à risque d’hématome à la suite d’une injection intramusculaire doit être évalué par les professionnels de santé.
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit doivent être clairement enregistrés.
Interactions
Menveo peut être donné en même temps que les vaccins suivants : vaccin monovalent et vaccin combiné de l’hépatite A et de l’hépatite B, fièvre jaune, fièvre typhoïde (vaccin polyosidique Vi), encéphalite japonaise, rage et méningococcique du groupe B (Bexsero).
Chez l’adolescent (âgé de 11 à 18 ans), deux études ont évalué la co-administration de Menveo avec le vaccin tétanique, diphtérique et coquelucheux acellulaire adsorbé à teneur réduite en antigènes (Tdap) seul ou avec le vaccin Tdap et le vaccin quadrivalent papillomavirus humain (Types 6, 11, 16 et 18), recombinant (HPV). Ces deux études soutiennent la co-administration des vaccins.
Aucune augmentation de la réactogénicité ou de modification du profil de sécurité des vaccins n’a été observée. L’administration simultanée de Menveo avec les vaccins diphtérique, tétanique ou HPV n’a pas réduit la réponse immunitaire des vaccins.
L’administration de Menveo un mois après le Tdap a montré des réponses immunitaires vis-à-vis du sérogroupe W-135 plus basses, de manière statistiquement significative. Comme il n’y avait pas d’impact direct sur le pourcentage de sujets séroprotégés, les conséquences cliniques ne sont actuellement pas connues. Une légère diminution de la réponse immunitaire vis-à-vis de deux des trois antigènes de B. pertussis a été observée. La pertinence clinique de cette observation n’est pas connue. Après la vaccination, plus de 97% des sujets avaient des titres en anticorps détectables vis-à-vis des trois antigènes pertussiques.
Les données de sécurité et d’immunogénicité de la co-administation de Menveo avec d’autres vaccins pour enfants ne sont pas disponibles pour les enfants âgés de 2 à 10 ans.
L’administration simultanée de Menveo avec d’autres vaccins que ceux énoncés ci-dessus n’a pas été étudiée. Les vaccinations simultanées doivent toujours être administrées en des sites d'injection séparés et de préférence dans les deux bras. Il est nécessaire de contrôler si les réactions indésirables sont intensifiées par la coadministration.
La réponse immunologique peut être diminuée chez les personnes sous traitement immunosuppressif.
Grossesse
Les données cliniques sur la grossesse sont insuffisantes.
Dans des études non cliniques, Menveo n’a pas montré d’effets délétères directs ou indirects sur la grossesse, le développement embryonnaire ou fœtal, l’accouchement ou le développement postnatal. Considérant la gravité des maladies méningococciques invasives dues aux sérogroupes A, C, W-135 et Y de Neisseria meningitidis, une grossesse ne devrait pas empêcher la vaccination lorsque le risque d’exposition est clairement établi.
Allaitement
Bien que les données cliniques sur l’administration de Menveo durant l’allaitement soient insuffisantes, il est improbable que les anticorps sécrétés dans le lait maternel soient délétères pour le nourrisson allaité. Par conséquent, Menveo peut être utilisé durant l’allaitement.
Effets indésirables
1. Résumé des effets indésirables
Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre de gravité décroissante.
Les fréquences sont définies comme suit :
- très fréquents : ≥ 1/10 ;
- fréquents : ≥ 1/100 à < 1/10 ;
- peu fréquents : ≥ 1/1 000 à < 1/100 ;
- rares : ≥ 1/10 000 à < 1/1 000 ;
- très rares : < 1/10 000 ;
- fréquence indéterminée (ne peut pas être estimée sur la base des données disponibles).
1.1. Réactions indésirables provenant des essais cliniques
1.1.1. Enfants âgés de 2 à 10 ans
Au total, 3 464 enfants âgés entre 2 et 10 ans ont été exposés à Menveo au cours d'études cliniques achevées. La caractérisation du profil de sécurité de Menveo chez les enfants âgés de 2 à 10 ans repose sur les données de quatre essais cliniques durant lesquels 3 181 sujets ont reçu Menveo.
Les réactions indésirables le plus fréquemment observées durant les essais cliniques persistaient généralement pendant un à deux jours et n’étaient pas graves. Ces réactions indésirables ont été :
Troubles du métabolisme et de la nutrition
- Fréquent : trouble alimentaire.
Affections du système nerveux
- Très fréquent : somnolence, céphalée.
Affections gastro-intestinales
- Fréquent : nausées, vomissements, diarrhée.
Affections de la peau et du tissu sous-cutané
- Fréquent : rash.
Affections musculo-squelettiques et systémiques
- Fréquent : myalgies, arthralgies.
Troubles généraux et anomalies au site d’administration
- Très fréquent : irritabilité, malaise, douleur au site d’injection, érythème au site d’injection (≤ 50 mm), induration au site d’injection (≤ 50 mm).
- Fréquent : érythème au site d’injection (> 50 mm), induration au site d’injection (> 50 mm), frissons, fièvre ≥ 38 °C.
- Peu fréquent : prurit au site d’injection.
1.1.2. Sujets de 11 à 65 ans
La caractérisation du profil de sécurité de Menveo chez les adolescents et les adultes repose sur les données de cinq essais cliniques randomisés, contrôlés, incluant 6 401 sujets (âgés de 11 à 65 ans) qui ont reçu Menveo. Parmi les personnes qui ont reçu Menveo, 58,9 %, 16,4 %, 21,3 % et 3,4 % appartenaient respectivement aux groupes d’âge de 11 à 18 ans, de 19 à 34 ans, de 25 à 55 ans et de 56 à 65 ans. Les deux premières études de sécurité étaient randomisées, contrôlées contre produit de référence, qui incluaient respectivement des sujets âgés de 11 à 55 ans (N=2 663) et de 19 à 65 ans (N=1 606).
L’incidence et la gravité de toute réaction locale, systémique ou autres réactions étaient généralement semblables dans le groupe Menveo dans toutes les études et dans les groupes d’adolescents ou d’adultes. Le profil de réactogénicité et les taux d’événements indésirables parmi les sujets âgés de 56 à 65 ans qui ont reçu Menveo (N=216) étaient semblables à ceux observés dans le groupe de sujets âgés de 11 à 55 ans.
Les réactions indésirables locales et systémiques les plus fréquemment observées dans les essais cliniques étaient une douleur au site d’injection et des céphalées.
Les réactions indésirables rapportées dans trois études cliniques pivots et dans deux études cliniques complémentaires, sont énoncées par classe de systèmes d’organes ci-dessous. Les effets indésirables les plus fréquemment rapportés durant les essais cliniques ont duré généralement un ou deux jours et n’ont pas été graves.
Affections du système nerveux
- Très fréquent : céphalées.
- Peu fréquent : sensation vertigineuse.
Affections gastro-intestinales
- Très fréquent : nausée.
Affections de la peau et du tissu sous-cutané
- Fréquent : rash.
Affections musculo-squelettiques et systémiques
- Très fréquent : myalgies.
- Fréquent : arthralgies.
Troubles généraux et anomalies au site d'administration
- Très fréquent : douleur au site d'injection, érythème au site d'injection (< ou égal à 50 mm, induration au site d'injection (< ou égal à 50 mm), malaise.
- Fréquent : érythème au site d’injection (> 50 mm), induration au site d’injection (> 50 mm), fièvre ≥ 38 °C, frissons.
- Peu fréquent : prurit au site d'injection.
Dans le groupe des adolescents, la sécurité et la tolérance du vaccin étaient meilleures par rapport au Tdap et ne changeaient pas de façon substantielle lors de l’administration concomitante ou séquentielle des vaccins.
1.2. Surveillance après commercialisation (toutes tranches d'âges)
Affections hématologiques et du système lymphatique
- Rare : lymphadénopathie.
Affections du système immunitaire
- Fréquence indéterminée : hypersensibilité y compris anaphylaxie.
Affection du système nerveux
- Fréquence indéterminée : convulsion tonique, convulsion fébrile, syncope.
Affection de l'oreille et du labyrinthe
- Fréquence indéterminée : vertige.
Troubles généraux et anomalies au site d'administration
- Fréquence indéterminée : cellulite au site d'injection, gonflement au site d'injection, y compris gonflement étendu du membre vacciné.
2. Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Aucune étude sur les effets sur l’aptitude à conduire ou utiliser des machines n’a été effectuée. Des sensations vertigineuses ont très rarement été rapportées après vaccination. Ceci peut temporairement affecter les capacités à conduire un véhicule ou à utiliser des machines.
3. Surdosage
Aucun cas de surdosage n’a été rapporté.
4. Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet :www.signalement-sante.gouv.fr.
Pharmacodynamie
Classe pharmacothérapeutique : Vaccins antiméningococciques.
Code ATC : J07AH08.
1. Immunogénicité de Menveo liquide
L'immunogénicité de Menveo liquide, a été étudiée dans un essai clinique de phase 2b, contrôlé, randomisé, multicentrique en simple aveugle, chez des sujets âgés de 10 à 40 ans qui aévalué la non-infériorité pour le MenA du Menveo liquide (pour le produit âgé de 24 et 30 mois) comparativement à
Menveo lyophilisé/liquide, est présentée dans le Tableau A.
La non-infériorité de Menveo liquide comparativement à Menveo lyophilisé/liquide a été démontrée pour le MenA selon les deux co-critères primaires d'évaluation de l'étude (entre les groupes ratio de moyennes géométriques de titres (MGT) un mois post-vaccination avec une formulation âgée de 24 et
30 mois).
Tableau A : Réponses en anticorps bactéricides sériques un mois après la vaccination par Menveo liquide ou Menveo lyophilisé/liquide chez les sujets âgés de 10 à 40 ans.
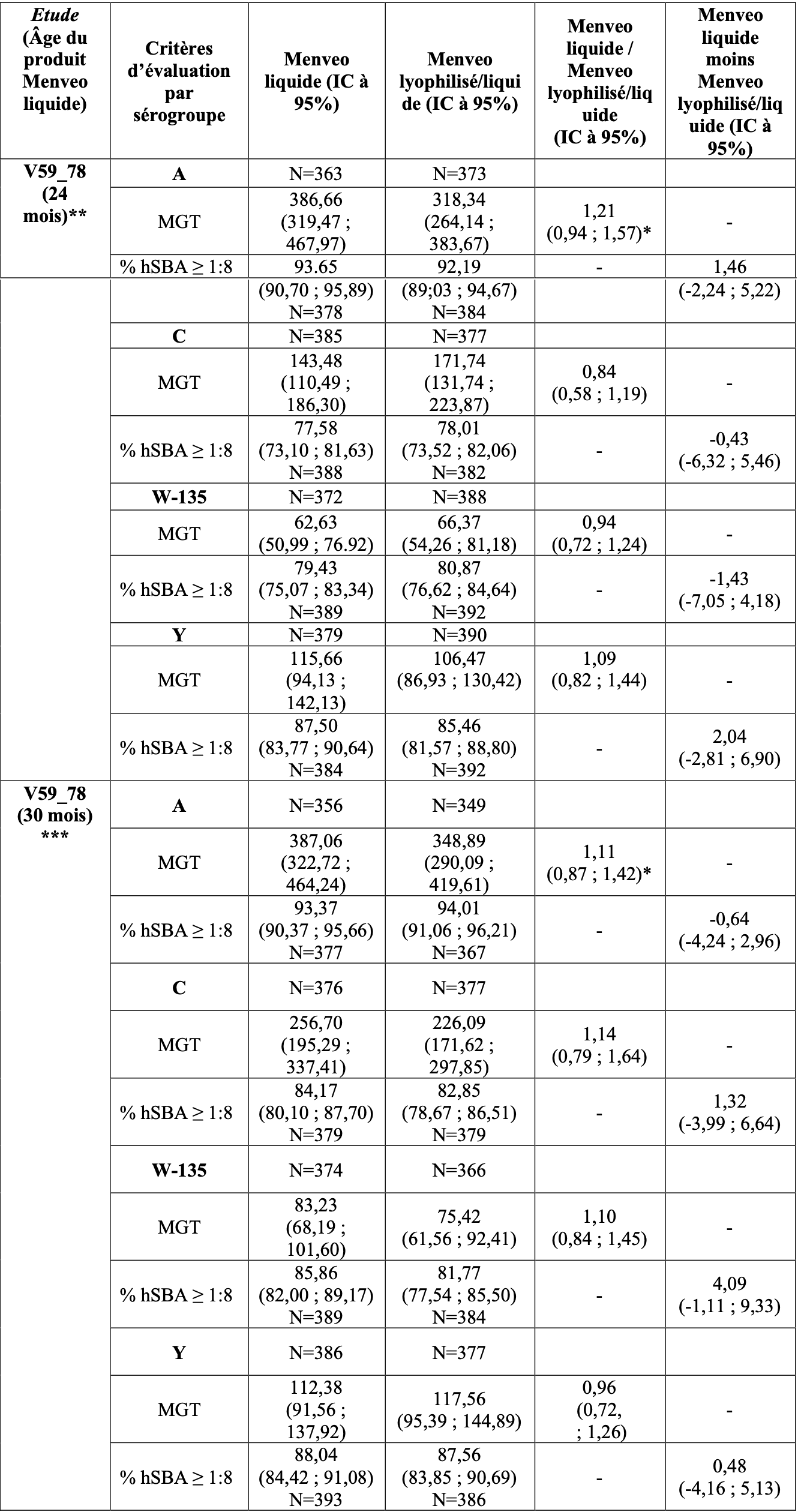
liquide / Menveo lyophilisé/liquide]).
*** Fait référence à la partie 2 de l’étude V59_78, dans laquelle Menveo liquide de 30 mois a été utilisé.
2. Immunogénicité de Menveo lyophilisé/liquide
L’efficacité de Menveo a été extrapolée en mesurant la production d’anticorps anti-capsulaire spécifiques de sérogroupes avec activité bactéricide. L’activité bactéricide du sérum (SBA) a été mesurée en utilisant le sérum humain comme source de complément exogène (hSBA). Le hSBA a été considéré comme le marqueur de protection contre les infections à méningocoques.
L’immunogénicité a été évaluée dans des essais cliniques contrôlés contre produit de référence, randomisés, multicentriques qui ont inclus des enfants (âgés de 2 à 10 ans), des adolescents (âgés de 11 à 18 ans), des adultes (âgés de 19 à 55 ans) et des personnes plus âgées (56-65 ans).
2.1. Immunogénicité chez les enfants âgés de 2 à 10 ans
Dans l’étude pivot V59P20, l’immunogénicité de Menveo a été comparée au vaccin méningococcique quadrivalent, conjugué à l’anatoxine diphtérique (ACWY-D) ; 1 170 enfants ont été vaccinés avec Menveo et 1 161 ont reçu le vaccin comparateur selon les populations per protocol. Dans deux études complémentaires V59P8 et V59P10, l’immunogénicité de Menveo a été comparée au vaccin ACWYPS (ACWY-polyosidique).
Dans l’étude pivot V59P20, randomisée, menée en simple insu du vaccin administré, dans laquelle les participants ont été stratifiés par âge (2 à 5 ans et 6 à 10 ans), l’immunogénicité d’une dose unique de Menveo un mois après la vaccination a été comparée à une dose unique de ACWY-D . Les résultats d’immunogénicité un mois après la vaccination par Menveo chez les sujets âgés de 2 à 5 ans et de 6 à 10 ans sont résumés ci-dessous dans le tableau 1.
Tableau 1 : réponses en anticorps bactéricides sériques un mois après la vaccination avec Menveo chez les sujets âgés de 2 à 5 ans et de 6 à 10 ans

Dans une autre étude randomisée, menée en simple insu du vaccin administré, aux États-Unis (V59P8), des enfants ont été immunisés avec une dose unique de Menveo (N=284) ou de ACWY-PS (N=285). Chez les enfants âgés de 2 à 10 ans, ainsi que chez les enfants de chaque sous-population (2-5 ans et 6-10 ans), les réponses immunitaires, mesurées par le pourcentage de sujets avec séroréponse hSBA≥1:8et les moyennes géométriques des titres (MGTs), étaient non seulement non-inférieures au vaccin comparateur ACWY-PS, mais aussi statistiquement plus élevées que celles du vaccin comparateur, pour tous les sérogroupes et pour toutes les mesures d’immunisation à1 mois après la vaccination. Un an après la vaccination, Menveo continuait à être statistiquement supérieur à ACWY-PS pour les sérogroupes A, W-135 et Y, mesuré par le pourcentage de sujets avec unhSBA≥1:8et les MGTs. Menveo était non-inférieur sur ces critères d’évaluation pour le sérogroupeC (Tableau 2). La pertinence clinique des réponses immunitaires post-vaccination plus élevées est inconnue.
Tableau 2 : immunogénicité d’une dose de Menveo ou ACWY-PS chez des sujets âgés de 2 à 10 ans, mesurée un mois et douze mois après la vaccination

Dans une étude randomisée, menée en simple insu du vaccin administré (V59P10) conduite en Argentine, des enfants ont été immunisés avec une dose unique de Menveo (N=949) ou avec ACWY-PS (N=551). L’immunogénicité a été évaluée dansun sous-groupe de 150 sujets pour chaque groupe de vaccin. La réponse immunitaire observée chez les enfants âgés de 2 à 10 ans était très semblable à celle observée dans l’étude V59P8présentée ci-dessus ; la réponse immunitaire à Menveo, 1 mois après vaccination, mesurée par le pourcentage de sujets avec séroréponse,hSBA≥1:8 et MGTs, était non-inférieure à celle d’ACWY-PS.
Une étude randomisée, menée en simple insu du vaccin administré, a été réalisée chez des enfants âgés de 12 à 59 mois en Finlande et en Pologne (V59P7). La population per protocole comprenait un total de 199 sujets âgés de 2 à 5 ans dans le groupe Menveo et 81 sujets, âgés de 3 à 5 ans dans le groupe ACWY-PS.
Un mois après la première vaccination, le pourcentage de sujets avec hSBA≥1:8 était plus élevé dans le groupe Menveo par rapport au groupe ACWY-PS pour les quatre sérogroupes A, C, W-135 et Y (respectivement 63 % vs 39 % , 46 % vs 39 %, 78 % vs 59 %, et 65 % vs 57 %).
Au cours de l'étude V59_57 randomisée et menée aux Etats-unis, l'immunogénicité de 2 doses de Menveo à été comparée à celle d'une dose de Menveo chez des enfants dans deux tranches d'âges différentes, entre 2 et 5 ans et entre 6 et 10 ans (N=715).
À l'inclusion, la proportion de sujets dans les deux tranches d'âge qui présentaient un hSBA ≥1:8 se situait entre 1 % et 5 % pour le sérogroupe A, entre 13 % et 28 % pour le sérogroupe C, entre 42 % et 64 % pour le sérogroupe W-135 et entre 6 % et 19 % pour le sérogroupe Y. Un mois après la dernière vaccination, cette proportion dans chaque groupe de traitement (2 doses comparé à une dose) et dans les deux tranches d'âge était : de 90 % à 95 % comparé à 76 % à 80 % pour le sérogroupe A, de 98 % à 99 % comparé à 76 % à 87 % pour le sérogroupe C, 99 % comparé à 93 % à 96 % pour le sérogroupe W-135 et de 96 % comparé à 65 % à 69 % pour le sérogroupe Y. Un mois après la vaccination, la moyenne géométrique des titres (MGT) était plus élevée dans le groupe ayant reçu 2 doses que dans celui en ayant reçu une seule, pour les deux tranches d'âges, la différence étant toutefois moins prononcée chez les sujets les plus âgés.
Un an après la dernière vaccination, la proportion de sujets qui présentaient un hSBA ≥1:8 était moins élevée que celle observée un mois après la vaccination, pour les deux groupes de traitement (sérogroupe A : 30 % pour le groupe ayant reçu 2 doses et de 11 % à 20 % pour celui ayant reçu une seule dose ; sérogroupe C : de 61 % à 81 % comparé à 41 % à 55 % ; sérogroupe W-135 : de 92 % à 94 % comparé à 90 % à 91 % ; sérogroupe Y : de 67 % à 75 % comparé à 57 % à 65 %). Les différences de MGT de l'hSBA entre les deux groupes de traitement après un an de vaccination étaient moins élevées que celles observées un mois après la vaccination.
Le bénéfice clinique de la vaccination à 2 doses chez les enfants âgés de 2 à 10 ans reste inconnu.
2.2. Persistance de la réponse immunitaire et de la réponse à la dose de rappel chez les enfants de 2 à 10 ans
La persistance des anticorps à 5 ans après une primovaccination a été évaluée au cours de l’étude V59P20E1, qui était une extension de l’étude V59P20. Une persistance des anticorps a été observéecontre les sérogroupes C, W-135 et Y ; le pourcentage de sujets ayant un hSBA ≥1:8 était de 32 % et 56 % contre le sérogroupe C chez les sujets âgés de 2 à 5 ans et de 6 à 10 ans, respectivement, de 74 % et 80 % contre le sérogroupe W-135 et de 48 % et 53 % contre le sérogroupe Y. Les MGT étaient respectivement de 6,5 et 12 pour le sérogroupe C, de 19 et 26 pour le sérogroupe W-135 et de 8,13 et 10 pour le sérogroupe Y. Pour le sérogroupe A, 14 % et 22 % des sujets de 2 à 5 ans et de 6 à 10 ans, respectivement, avaient un hSBA ≥1:8 (MGT 2,95 et 3,73).
Les enfants ont également reçu une dose de rappel de Menveo 5 ans après la dose unique de primovaccination. Tous les sujets des deuxgroupes d’âge avaient un hSBA ≥ 1:8 pour tous les sérogroupes, et les titres des anticorps étaient nettement plus élevés que ceux observés après la primovaccination (tableau 3).
Tableau 3 : persistance des réponses immunitaires 5 ans après la primovaccination par Menveo et réponses immunitaires 1 mois après la dose de rappel chez des sujets âgés de 2 à 5 ans et de 6 à 10 ans au moment de la primovaccination

2.3. Immunogénicité chez les sujets âgés de 11 ans et plus
Dans l’étude pivot (V59P13), des adolescents et des adultes ont reçu une dose de Menveo (N=2649)ou de vaccin comparateur ACWY-D (N=875). Les sérums ont été prélevés avant la vaccination et 1 mois après.
Dans une autre étude (V59P6) conduite chez 524 adolescents, l’immunogénicité de Menveo a été comparée à celle d’ACWY-PS.
2.3.1. Immunogénicité chez les adolescents
Dans le groupe âgé de 11 à 18 ans de l’étude pivot V59P13, l’immunogénicité d’une dose uniquede Menveo un mois après la vaccination a été comparée à celle du vaccin comparateur ACWY-D. Les résultats d’immunogénicité un mois après Menveo sont résumés ci-dessous dans le tableau 4.
Tableau 4 : réponses en anticorps bactéricides sériques un mois après la vaccination avec Menveo chez les sujets âgés de 11 à 18 ans

Dans le sous-groupe de sujets âgés de 11 à 18 ans qui étaient séronégatifs à l’inclusion, la proportion de sujets qui présentaient un hSBA≥1:8après une dose de Menveo était : sérogroupe A 75 % (780/1039) ; sérogroupe C 80 % (735/923) ; sérogroupe W135 94 % (570/609) ; sérogroupe Y 81 % (510/630).
Dans l'étude de non-infériorité V59P6, l'immunogénicité a été évaluée chez des adolescents âgés de 11 à 17 ans qui ont été randomisés pour recevoir Menveo ou ACWY-PS. Fondée sur la réponse immunitaire, la proportion atteignant un hSBA≥1:8, et la moyenne géométrique des titres (MGT),la non infériorité de Menveo par rapport au vaccin ACWY-PS a été démontrée pour les quatre sérogroupes (A, C, W-135 et Y).
Tableau 5. immunogénicité d’une dose de Menveo ou d’ACWY-PS chez les adolescents, mesurée un mois après la vaccination.

Un an après la vaccination, chez ces mêmes sujets, comparés au vaccin ACWY-PS, une proportion plus élevée de sujets vaccinés avec Menveo avaient un hSBA≥1:8pour les sérogroupes C, W-135 et Y, avec des niveaux comparables pour le sérogroupe A. Des données identiques étaient observées pour les comparaisons des MGT d’hSBA
2.3.2. Persistance de la réponse immunitaire et de la réponse à la dose de rappel chez les adolescents
Dans l'étude V59P13E1, la persistance des réponses immunitaires contre les sérogroupes A, C, W-135 et Y a été évaluée à 21 mois, 3 ans et 5 ans après la primovaccination chez des sujets âgés de 11 à 18 ans au moment de la vaccination. Le pourcentage de sujets ayant un hSBA ≥ 1:8 est resté constant contre les sérogroupes C, W-135, et Y entre 21 mois et 5 ans après la vaccination dans le groupe Menveo et a légèrement diminué au fil du temps contre le sérogroupe A (tableau 6). Cinq ans après la primovaccination, le pourcentage de sujets ayant un hSBA ≥ 1:8 était significativement plus élevé dans le groupe Menveo par rapport aux témoins non vaccinés contre les quatre sérogroupes.
Tableau 6 : persistance des réponses immunitaires environ 21 mois, 3 ans et 5 ans après la vaccination par Menveo (sujets âgés de 11 à 18 ans au moment de la vaccination)

Une dose de rappel de Menveo a été administrée 3 ans après la primovaccination par Menveo ou ACWY-D. Les deux groupes ont présenté une réponse solide à la dose de rappel de Menveo un mois après la vaccination (100 % des sujets avaient un hSBA ≥1:8 dans tous les sérogroupes) qui a généralement persisté 2 ans après la dose de rappel pour les sérogroupes C, W-135 et Y (87 % à 100 % des sujets avaient un hSBA ≥1:8 dans tous les sérogroupes). Une légère baisse du pourcentage des sujets ayant un hSBA ≥1:8 contre le sérogroupe A a été observé, même s'il était toujours élevé (77 % à 79 %). Les MGT ont diminué au fil du temps comme attendu mais sont restés 2 à 8 fois plus élevés que les valeurs antérieures à la dose de rappel (tableau 8).
Dans l'étude V59P6E1, un an après la vaccination, le pourcentage de sujets vaccinés par Menveo ayantun hSBA ≥1:8 est resté significativement plus élevé que celui des sujets vaccinés par ACWY-PS pour les sérogroupes C, W-135 et Y, et était similaire entre les deux groupes d'étude pour le sérogroupe A. Les MGT d'hSBA pour les sérogroupes W-135 et Y étaient plus élevés dans le groupe Menveo. Dans les 5 années suivant la vaccination, le pourcentage de sujets vaccinés par Menveo ayant un hSBA ≥1:8 est resté significativement plus élevé que celui des patients vaccinés par ACWY-PS pour les sérogroupes C et Y. Des MGT d'hSBA plus élevés ont été observés pour les sérogroupes W-135 et Y (tableau 7).
Tableau 7 : persistance des réponses immunitaires environ 12 mois et 5 ans après la vaccination par Menveo et ACWY-PS (sujets âgés de 11 à 18 ans au moment de la vaccination)

Une dose de rappel de Menveo a été administrée 5 ans après la primovaccination par Menveo ou ACWY-PS. Sept jours après la dose de rappel, 98 % à 100 % des sujets précédemment vaccinés par Menveo et 73 % à 84 % des sujets précédemment vaccinés par ACWY-PS ont obtenu un hSBA≥1:8contre les sérogroupes A, C, W-135 et Y. Un mois après la vaccination, le pourcentage de sujets ayant un hSBA≥1:8était respectivement de 98 % à 100 % et de 84 % à 96 %.
Une augmentation significative des MGT d'hSBA contre les quatre sérogroupes a également été observée 7 et 28 jours après la dose de rappel (tableau 8).
Tableau 8 : réponse à la dose de rappel : réponses en anticorps bactéricides à la dose de rappel de Menveo administrée 3 ou 5 ans après la primovaccination par Menveo ou ACWY-PS chez des sujets âgés de 11 à 17 ans

2.3.3. Immunogénicité chez les adultes
Dans l’étude pivot d’immunogénicité, V59P13, les réponses immunitaires Menveo ont été mesurées chez les adultes âgés de 19 à 55 ans. Les résultats sont présentés dans le tableau 9. Dans le sous-groupe de sujets âgés de 19 à 55ans qui étaient séronégatifs à l’inclusion, la proportion de sujets qui présentaient un hSBA≥1:8 après une dose de Menveo était : sérogroupe A 67 % (582/875) ; sérogroupe C 71 % (401/563) ; sérogroupe W-135 82 % (131/160) ; sérogroupe Y 66 % (173/263).
Tableau 9 : réponses en anticorps bactéricides sériques humain (hSBA) un mois après la vaccination avec Menveo chez les sujets âgés de 19 à 55 ans

L’initiation de la réponse immunitaire après la primovaccination par Menveo chez des sujets sains âgés de 18 à 22 ans a été évaluée dans l'étude V59P6E1. Sept jours après la vaccination, 64 % dessujets ont obtenu un hSBA ≥1:8 contre le sérogroupe A et 88 % à 90 % des sujets présentaient des anticorps bactéricides contre les sérogroupes C, W-135 et Y. Un mois après la vaccination, 92 %à 98 % des sujets présentaient un hSBA ≥1:8contre les sérogroupes A, C, W-135 et Y. Une réponse immunitaire robuste mesurée par les MGT d'hSBA contre tous les sérogroupes a également été observée au bout de 7 jours (MGT 34 à 70) et de 28 jours (MGT 79 à 127) après une seule dose de vaccin.
2.3.4. Immunogénicité chez les personnes âgées
L’immunogénicité de Menveo comparée à celle de ACWY-PS a été évaluée chez des sujets âgés de 56 à 65 ans dans l’étude V95P17. La proportion de sujets ayant des titres d’hSBA ≥1:8 n’était pas inférieure à celle d’ACWY-PS pour les quatre sérogroupes et statistiquement supérieure pour les sérogroupes A et Y (Tableau 10).
Tableau 10 : immunogénicité d’une dose de Menveo et d’ACWY-PS un mois après la vaccination chez les sujets âgés de 56 à 65 ans

2.3.5. Données disponibles chez les enfants de 2-23 mois
L’immunogénicité de Menveo chez les enfants âgés de 2 à 23 mois a été évaluée dans plusieurs études. Bien qu'un pourcentage élevé de sujets ait obtenu des titres hSBA supérieurs à 1:8 après 4 doses de Menveo et un pourcentage moindre dans des études avec 2 doses ou une doseunique, Menveo n’a été comparé à un autre vaccin méningococcique que dans une seule étude pivot laquelle n'a pas montré de réponse au moins équivalente à celle d'un vaccin monovalent conjugué de sérogroupe C (après l'administration d'une dose unique à l'âge de 12 mois). Les données actuellementdisponibles ne sont pas suffisantes pour établir l’efficacité de Menveo chez les enfants de moinsde 2 ans. Voir la rubrique "Posologie" pour plus d'informations sur l'usage pédiatrique.
Conservation
1. Poudre et solution pour solution injectable.
Durée de conservation : 4 ans.
Après reconstitution, le produit doit être utilisé immédiatement. Toutefois, la stabilité physico-chimique après reconstitution a été démontrée jusqu’à 8 heures à une température ne dépassant pas 25 °C.
A conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler.
Conserver les flacons dans l’emballage extérieur à l’abri de la lumière.
2. Solution injectable prête à l'emploi
Durée de conservation : 2 ans.
À conserver au réfrigérateur (entre 2 et 8 °C).
Ne pas congeler.
Conserver le(s) flacon(s) dans l’emballage extérieur à l’abri de la lumière.
Les données de stabilité indiquent que le vaccin non ouvert est stable jusqu'à 24 heures lorsqu'il est conservé à 25 °C. À la fin de cette période, le liquide Menveo doit être utilisé ou jeté. Ces informations sont destinées à guider les professionnels de santé en cas d'excursion temporaire de
température uniquement.
Manipulation
1. Poudre et solution pour solution injectable.
Menveo doit être préparé pour l’administration en reconstituant la poudre (en flacon) avec la solution (en flacon).
Le contenu des deux différents flacons (poudre MenA et solution MenCWY) doit être mélangé avant la vaccination, pour obtenir une dose de 0,5 mL.
Les composants de ce vaccin doivent être inspectés visuellement avant et après la reconstitution.
Au moyen d’une seringue et d’une aiguille appropriée (21G, 40 mm de long ou 21G, 1 1⁄2 pouce delong), prélever tout le contenu du flacon contenant la solution et l’injecter dans le flacon contenant la poudre pour reconstituer le composant conjugué MenA.
Retourner et agiter vigoureusement le flacon puis prélever 0,5 mL de produit reconstitué. Veuillez noter qu’il est normal qu’une petite quantité de liquide reste dans le flacon après le prélèvement de la dose.
Après reconstitution, le vaccin est une solution transparente, incolore à jaune clair, sans particules étrangères visibles. Dans le cas ou des particules étrangères et/ou un changement de l’aspect physique seraient observés, jeter le vaccin.
Avant l’injection, changer l’aiguille en la remplaçant par une aiguille appropriée à l’injection. S’assurer qu’il n’y a pas de bulles d’air dans la seringue avant d’injecter le vaccin.
2. Solution injectable prête à l'emploi
Le vaccin est une solution injectable prête à l’emploi.
Le vaccin doit être inspecté visuellement avant administration.
Le vaccin est une solution claire et incolore, exempte de particules étrangères visibles. En cas de présence de particules étrangères et/ou de changement de l'aspect physique, ne pas administrer le vaccin.
Au moyen d'une seringue et d'une aiguille appropriée, prélever tout le contenu du flacon.
Avant l'injection, changer l'aiguille en la remplaçant par une aiguille adaptée pour l'administration. S’assurer qu'il n'y a pas de bulles d'air dans la seringue avant d'injecter le vaccin.
3. Commun aux deux formes pharmaceutiques
Ce médicament ne doit pas être mélangé avec d’autres médicaments.
L'administration du vaccin doit être consignée par le médecin sur le carnet de vaccination ou de santé avec le numéro de lot. Il peut aussi être inscrit par le patient ou son médecin sur un carnet de vaccination numérique (version grand public ou professionnelle).
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Autres informations
Données de sécurité préclinique
Les données non cliniques issues des études conventionnelles de toxicologie en administration répétée et des fonctions de reproduction et de développement, n’ont pas révélé de risque particulier pour l’homme.
Chez les animaux de laboratoire, aucune réaction indésirable n’a été observée chez les lapines vaccinées ou sur leur descendance jusqu’à 29 jours post-partum.
Aucun effet sur la fertilité n’a été observé chez les lapines qui ont reçu Menveo avant l’accouplement et durant la grossesse.
Remboursement
Remboursé par la Sécurité Sociale à 65% dans le cas suivant :
- Prévention des formes invasives d'infections par certaines formes de la bactérie Neisseria meningitidis (méningites à méningocoques) chez les enfants âgés de 5 ans à 24 ans, risquant de se trouver en contact avec cette bactérie, dans certains cas uniquement (problèmes de santé entraînant une baisse de l'immunité (sujet avec déficit en fraction terminale du complément, ou recevant un traitement anti-C5A ou avec déficit en properdine, ou asplénique (anatomique ou fonctionnel) ou greffé de moelle).
JOURNAL OFFICIEL ; 23/09/15
Cette présentation est agréée aux collectivités.