ROTARIX
Laboratoire : GSK Vaccines
La HAS a recommandé le 23 juin 2022 la vaccination contre les rotavirus de tous les nourrissons âgés de 6 semaines à 6 mois. Depuis le 25 novembre 2022 (arrêté du 17 novembre 2022), ce vaccin est remboursé à 65 % chez tous les nourrissons âgés de 6 semaines à 24 semaines pour la prévention des gastro-entérites dues à une infection à rotavirus.
Description
Vaccin monovalent contre les rotavirus, par voie orale
Forme et Présentation
Rotarix suspension buvable en applicateur prérempli pour administration orale
Rotarix suspension buvable en tube souple
Rotarix suspension buvable en présentation multidose de 5 tubes souples unidoses reliés par une plaque
Rotarix suspension buvable en tube souple est le seul conditionnement commercialisé en France.
Rotarix est un liquide limpide et incolore.
Nature et contenu de l'emballage extérieur
- Applicateur prérempli pour administration orale
1,5 mL de suspension buvable en applicateur prérempli pour administration orale (verre de type I) avec un bouchon-piston (caoutchouc butyle) et un capuchon protecteur (caoutchouc butyle) en boîte de 1, 5, 10 ou 25. - Tube souple
1,5 mL de suspension buvable en tube souple (polyéthylène) muni d’une membrane et d’un capuchon protecteur (polypropylène), en boîte de 1, 10 ou 50. - Présentation multidose de 5 tubes souples unidoses reliés par une plaque
1,5 mL de suspension buvable en tube souple (polyéthylène) présenté sous forme de barrette multidose de 5 tubes souples unidoses reliés par une plaque, en boîte de 50 tubes.
Toutes les présentations peuvent ne pas être commercialisées.
Composition
Une dose (1 mL) contient après reconstitution :
1. Antigène
- Rotavirus humain, souche RIX4414 (vivante atténuée) * : ≥106.0 DICC50
2. Excipients
Poudre
- Saccharose
- Dextran
- Sorbitol
- Acides aminés
- Milieu Eagle modifié de Dulbecco (DMEM) (contenant de la phénylalanine, du sodium, du glucose, et d’autres substances)
Solvant
- Carbonate de calcium
- Gomme xanthane
- Eau stérile
Excipients à effet notoire
Ce produit contient 1073 mg de saccharose, 32 mg de sodium, 10 microgrammes de glucose et 0,15 microgrammes de phénylalanine par dose "Mise en garde et précautions d'emploi").
Indications
Rotarix est indiqué dans l’immunisation active des nourrissons âgés de 6 à 24 semaines pour la prévention des gastro-entérites dues à une infection à rotavirus (voir les rubriques "Posologie", "Mises en garde et précautions d'emploi" et "Pharmacodynamie").
L'utilisation de Rotarix doit se baser sur les recommandations officielles.
Nouvelle recommandation en 2022
La vaccination contre les rotavirus est recommandée chez l’ensemble des nourrissons âgés de 6 semaines à 6 mois pour les protéger contre les gastroentérites liées à ces virus.
Posologie
Le schéma de vaccination comporte 2 doses. La première dose peut être administrée à partir de l'âge de 6 semaines. L'intervalle entre les doses doit être au moins de 4 semaines. Le schéma de vaccination doit préférentiellement être administré avant l'âge de 16 semaines, et doit être terminé avant l'âge de 24 semaines.
Rotarix peut être administré à la même posologie à des nourrissons nés prématurés à 27 semaines de grossesse ou plus (voir rubriques "Effets indésirables" et "Pharmacodynamie").
Dans les essais cliniques, le vaccin a rarement été craché ou régurgité et, dans ces circonstances, une dose de remplacement n'a pas été administrée. Cependant, dans l'éventualité rare où un nourrisson recrache ou régurgite la majeure partie de la dose administrée de vaccin, une dose unique de remplacement peut être donnée lors de la même consultation.
Il est recommandé aux nourrissons qui ont reçu une première dose de Rotarix de terminer le schéma de vaccination en 2 doses avec Rotarix. Il n'y a aucune donnée de tolérance, d'immunogénicité ou d'efficacité quand Rotarix est administré comme première dose et un autre vaccin à rotavirus comme seconde dose ou vice versa.
Population pédiatrique
Rotarix ne doit pas être utilisé chez l’enfant âgé de plus de 24 semaines.
Mode d'administration
Rotarix doit être administré uniquement par voie orale.
Rotarix ne doit jamais être injecté.
Pour les instructions pour la préparation ou la reconstitution du médicament avant administration, voir rubrique "Manipulation".
Contre-indications
Hypersensibilité à la substance active ou à l'un des excipients.
Hypersensibilité suite à une précédente administration de vaccins rotavirus.
Antécédents d'invagination intestinale.
Sujets ayant une malformation congénitale non opérée de l’appareil gastro-intestinal pouvant prédisposer à une invagination intestinale.
Sujets ayant une ImmunoDéficience Combinée Sévère (IDCS) (voir rubrique "Effets indésirables").
L'administration de Rotarix doit être différée chez les sujets ayant une maladie fébrile sévère aiguë. La présence d'une infection bénigne n'est pas une contre-indication à la vaccination.
L'administration de Rotarix doit être différée chez les sujets présentant une diarrhée ou des vomissements.
Mises en garde et précautions d'emploi
La vaccination doit être précédée d’une recherche des antécédents médicaux notamment concernant les contre-indications et d’un examen clinique.
Il n’y a aucune donnée de tolérance et d’efficacité de Rotarix chez les nourrissons ayant une pathologie gastro-intestinale ou un retard de croissance. L’administration de Rotarix peut être considérée avec prudence chez ces nourrissons quand, selon l’avis du médecin, le fait de différer la vaccination entraîne un risque plus grand.
Par mesure de précaution, les professionnels de santé doivent surveiller tout symptôme évocateur d'une invagination intestinale (douleur abdominales sévères, vomissements persistants, présence de sang dans les selles, ballonnements abdominaux et/ou fièvre élevée) car les données issues d'études observationnelles de tolérance indiquent une augmentation du risque d'invagination intestinale, principalement dans les 7 jours suivant l'administration d'un vaccin à rotavirus (voir rubrique "Effets indésirables"). Il doit être recommandé aux parents/tuteurs de rapporter immédiatement de tels symptômes à leurs professionnels de santé.
Pour les sujets ayant une prédisposition aux invaginations intestinales, voir rubrique "Contre indications".
Une altération de la tolérance ou de l’efficacité de Rotarix n’est pas attendue dans le cas d’une infection par le VIH asymptomatique ou légèrement symptomatique. Un essai clinique réalisé chez un nombre limité de nourrissons séropositifs au VIH et asymptomatiques ou légèrement symptomatiques n’a montré aucun problème apparent de tolérance (voir rubrique "Effets indésirables").
L’administration de Rotarix à des nourrissons ayant une immunodéficience connue ou suspectée, y compris suite à une exposition in utero à un traitement immunosuppresseur, doit être soigneusement évaluée compte tenu des bénéfices et des risques potentiels
L’excrétion du virus vaccinal dans les selles est connue pour survenir après vaccination avec un pic d’excrétion vers le 7ème jour. Les particules antigéniques virales détectées par ELISA ont été retrouvées dans 50 % des selles après la 1ère dose et dans 4 % des selles après la seconde dose. Quand la présence de souche vaccinale vivante a été recherchée dans les selles, seules 17 % des selles étaient positives.
Des cas de transmission de ces virus vaccinaux excrétés ont été observés chez des sujets contacts sans symptôme clinique associé.
Rotarix doit être administré avec prudence chez les personnes en contact proche avec des patients immunodéprimés, tels que des patients atteints d’affections malignes ou des patients sous traitement immunosuppresseur.
Les personnes en contact avec des sujets récemment vaccinés doivent observer des règles d’hygiène personnelle (tel que se laver les mains après avoir changé les couches du nourrisson).
Le risque potentiel d'apnée avec nécessité de surveillance respiratoire pendant 48-72 h doit être soigneusement pris en compte lors de l'administration des deux doses vaccinales chez les très grands prématurés (nés à 28 semaines de grossesse ou moins) et particulièrement chez ceux ayant des antécédents d'immaturité respiratoire.
En raison du bénéfice élevé de la vaccination chez ces nourrissons, l'administration ne doit pas être suspendue ou reportée.
Une réponse immunitaire protectrice peut ne pas être obtenue chez tous les sujets vaccinés (voir rubrique "Pharmacodynamie")
L’étendue de la protection que Rotarix pourrait conférer à d’autres souches de rotavirus qui n’ont pas circulées lors des essais cliniques n’est actuellement pas connue. Les données d’efficacité sont issues d’études cliniques réalisées en Europe, en Amérique Centrale et du Sud, en Afrique et en Asie (voir rubrique "Pharmacodynamie").
Rotarix ne protège pas contre les gastro-entérites dues à des pathogènes autres que les rotavirus.
Aucune donnée n’est disponible concernant l’utilisation de Rotarix en prophylaxie post-exposition.
Rotarix ne doit jamais être injecté.
Excipients
Ce vaccin contient du saccharose et du glucose en tant qu’excipient. Les sujets qui ont de rares problèmes héréditaires d’intolérance au fructose, de malabsorption du glucose-galactose ou de déficit en sucrase-isomaltase ne doivent pas recevoir ce vaccin.
Ce vaccin contient 0,15 microgrammes de phénylalanine par dose. La phénylalanine peut être dangereuse pour les personnes atteintes de phénylcétonurie (PCU).
Ce vaccin contient 32 mg de sodium par dose.
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Interactions
Rotarix peut être administré simultanément avec l’un des vaccins monovalents ou combinés suivants [incluant les vaccins hexavalents (DTCa-HepB-IPV/Hib)] : vaccin diphtérie-tétanos-coqueluche à germes entiers (DTCe), vaccin diphtérie-tétanos-coqueluche acellulaire (DTCa), vaccin Haemophilus influenzae de type b (Hib), vaccin poliomyélitique inactivé (IPV), vaccin hépatite B (HepB), vaccin conjugué pneumococcique et vaccin conjugué méningococcique du groupe C. Les études cliniques ont montré que les réponses immunitaires et les profils de tolérance des vaccins administrés n’étaient pas modifiés.
L’administration concomitante de Rotarix et du vaccin poliomyélitique oral (VPO) n’affecte pas la réponse immunitaire aux antigènes poliomyélitiques. Bien que l’administration concomitante du vaccin poliomyélitique oral puisse faiblement réduire la réponse immunitaire au vaccin rotavirus, un essai clinique impliquant plus de 4 200 sujets ayant reçu de façon concomitante Rotarix et le VPO a montré que la protection clinique contre les gastro-entérites à rotavirus sévères était conservée.
Il n’y a aucune restriction concernant la consommation de nourriture ou de liquide, y compris le lait maternel, que ce soit avant ou après la vaccination.
Grossesse
Rotarix n'étant pas destiné à l'adulte, il n'y a pas de données concernant l'utilisation du vaccin chez la femme pendant la grossesse et l'allaitement.
Allaitement
D'après les données issues des essais cliniques, l'allaitement ne réduit pas la protection contre les gastroentérites à rotavirus, conférée par Rotarix. Ainsi, l'allaitement peut être poursuivi pendant le schéma de vaccination.
Effets indésirables
1. Résumé des effets indésirables
1.1. Résumé du profil de tolérance
Le profil de sécurité présenté ci-dessous repose sur les données issues des essais cliniques réalisés, soit avec la formulation lyophilisée, soit avec la formulation liquide de Rotarix. Au cours de 4 essais cliniques, environ 3 800 doses de Rotarix formulation liquide ont été administrées à environ 1 900 nourrissons. Ces essais ont montré que le profil de sécurité de la formulation liquide est comparable à celui de la formulation lyophilisée.
Au cours des 23 études cliniques, environ 106 000 doses de Rotarix (formulation lyophilisée ou liquide) ont été administrées à environ 51 000 nourrissons.
Dans 3 essais cliniques contrôlés versus placebo (Finlande, Inde et Bangladesh), dans lesquels Rotarix a été administré seul (l’administration des vaccins pédiatriques usuels était décalée), l’incidence et la sévérité des événements sollicités (rapportés dans les 8 jours post-vaccination), diarrhées, vomissements, perte d’appétit, fièvre, irritabilité et toux/écoulement nasal n’étaient pas significativement différentes dans le groupe recevant Rotarix comparé au groupe placebo. Aucune augmentation de l’incidence ou de la sévérité de ces événements n’a été observée après la seconde dose.
Au cours d’une analyse poolée de 17 essais cliniques contrôlés versus placebo (Europe, Amérique du Nord, Amérique Latine, Asie, Afrique) incluant les essais dans lesquels Rotarix était co-administré avec des vaccins pédiatriques habituels (voir rubrique "Interactions"), les effets indésirables suivants (rapportés dans les 31 jours post-vaccination) ont été considérés comme possiblement liés à la vaccination.
1.2. Effets indésirables
Les effets indésirables rapportés sont listés selon les fréquences suivantes :
Les fréquences sont reportées comme suit :
- très fréquent : ≥ 1/10 ;
- fréquent : ≥ 1/100 à < 1/10 ;
- peu fréquent : ≥ 0,100 à < 1/100 ;
- rare : ≥ 1/10 000 à <1/1000 ;
- très rare : < 1/10000.
Affections gastro-intestinales
- Fréquent : diarrhée.
- Peu fréquents : douleurs abdominales, flatulences.
- Très rare : invagination intestinale (voir rubrique "Mise en garde et précaution d'emploi").
- Indéterminée * : rectorragies , gastroentérite avec excrétion du virus vaccinal chez les nourrissons ayant une Immuno Déficience Combinée Sévère (IDCS).
Affections de la peau et du tissu sous-cutané
- Peu fréquent : dermatites.
- Très rare : urticaire.
Troubles généraux et anomalies au site d’administration
- Fréquent : irritabilité.
Affections respiratoires, thoraciques et médiastinales
- Indéterminée * : apnée chez les très grands prématurés (≤ 28 semainesde grossesse) (voir rubrique "Mise en garde et précaution d'emploi").
1.3. Description de certains effets indésirables
Invagination intestinale
Les données d'études observationnelles de tolérance réalisées dans plusieurs pays indiquent que les vaccins à rotavirus sont associés à une augmentation du risque d'invagination intestinale, principalement dans les 7 jours suivant la vaccination. Jusqu'à 6 cas additionnels pour 100 000 nourrissons ont été observés dans ces pays, au regard d’une incidence basale annuelle de 25 à 101 pour 100 000 nourrissons (âgés de moins d'un an), respectivement.
Il existe des preuves limitées d'une faible augmentation de ce risque après la seconde dose.
A ce jour, il n'a pas été déterminé si les vaccins à rotavirus affectent l'incidence globale des invaginations intestinales sur la base de périodes de suivi plus longues (voir rubrique "Mise en garde et précaution d'emploi").
1.4. Autres populations spécifiques
Tolérance chez les nourrissons nés prématurés.
Dans une étude clinique, 670 nourrissons prématurés nés entre 27 à 36 semaines de grossesse ont reçu Rotarix et 339 un placebo. La première dose a été administrée à partir de l’âge de six semaines. Des événements indésirables graves ont été observés chez 5,1 % des nourrissons ayant reçu Rotarix et chez 6,8 % des nourrissons ayant reçu un placebo. Des taux similaires d’autres événements indésirables ont été observés chez les nourrissons ayant reçu Rotarix ou un placebo. Aucun cas d’invagination intestinale n’a été rapporté.
Tolérance chez les nourrissons infectés par le virus de l’immunodéficience humaine (VIH).
Dans une étude clinique, 100 nourrissons infectés par le VIH ont reçu du Rotarix ou un placebo. Le profil de sécurité était similaire entre les nourrissons ayant reçu Rotarix et ceux ayant reçu le placebo.
2. Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Sans objet
3. Surdosage
Des cas de surdosage ont été rapportés. En général, les événements indésirables rapportés dans ces cas étaient similaires à ceux observés après l'administration de la dose recommandée de Rotarix.
4. Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet :www.signalement-sante.gouv.fr.
Pharmacodynamie
Classe pharmacothérapeutique : vaccins contre les diarrhées à rotavirus.
Code ATC : J07BH01.
1. Efficacité protectrice
L'efficacité a été démontrée dans les essais cliniques, contre les gastro-entérites à rotavirus des génotypes les plus courants G1P [8], G2P [4], G3P [8], G4P [8] et G9P [8]. En outre, l'efficacité contre les génotypes peu fréquents de rotavirus G8P [4] (gastro-entérites sévères) et G12P [6] (autres gastro-entérites) a été démontrée. Ces souches sont en circulation à travers le monde.
Des études cliniques ont été conduites en Europe en Amérique Latine, en Afrique et en Asie pour évaluer l’efficacité protectrice de Rotarix contre toutes les gastro-entérites et les gastro-entérites à rotavirus (GERV) sévères.
La sévérité de la gastro-entérite était définie selon deux critères différents :
- l’échelle à 20 points de Vesikari qui évalue le tableau clinique complet de la gastro-entérite à rotavirus en tenant compte de la sévérité et de la durée de la diarrhée et des vomissements, lasévérité de la fièvre et de la déshydratation ainsi que la nécessité de recourir à un traitement, ou
- la définition des cas cliniques basée sur le critère de l’Organisation Mondiale de la Santé (OMS).
L’efficacité de la protection clinique était évaluée dans la cohorte per protocole (ATP) qui inclut tous les sujets entrant dans la période de suivi de l’efficacité.
1.1 Efficacité protectrice en Europe
Une étude clinique réalisée en Europe a évalué Rotarix administré selon différents schémas d’administration européens (2, 3 mois ; 2, 4 mois ; 3, 4 mois ; 3, 5 mois) chez 4 000 sujets.
Après 2 doses de Rotarix, l’efficacité protectrice du vaccin observée au cours des 1ère et 2ème années de vie est présentée dans le tableau suivant :
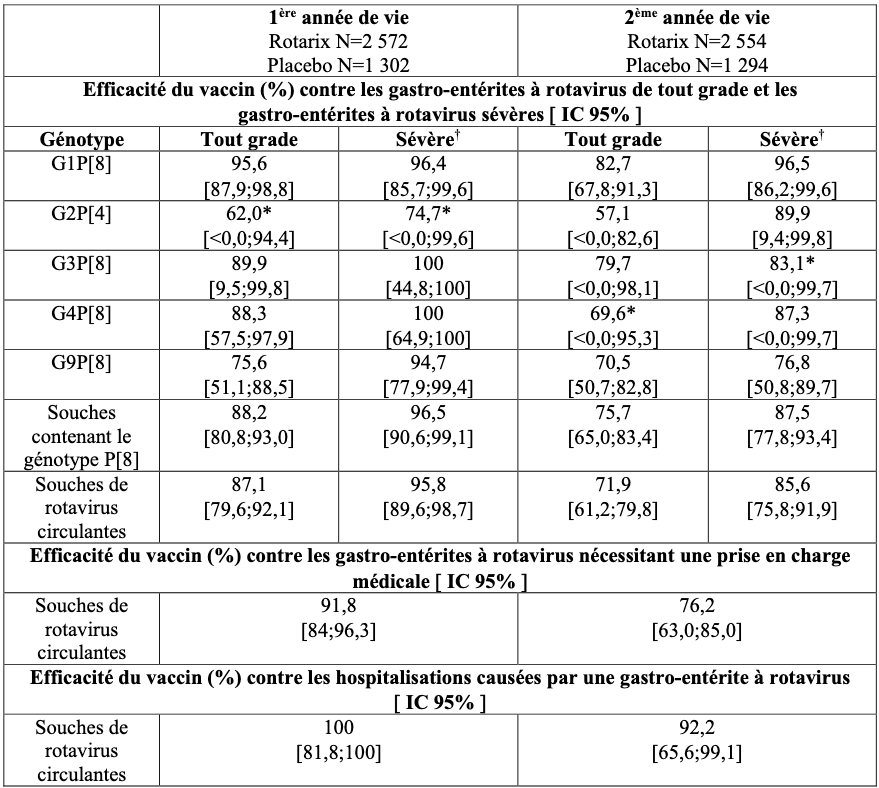

* Statistiquement non significatif (p ≥ 0,05). Ces données sont à interpréter avec précaution.
L’efficacité du vaccin durant la première année de vie a progressivement augmenté avec la sévérité de la maladie, en atteignant 100 % (IC 95 % : 84,7;100) pour les scores de Vesikari ≥17.
1.2. Efficacité protectrice en Amérique latine
Une étude clinique conduite en Amérique Latine a évalué Rotarix chez plus de 20 000 sujets. La sévérité des gastro-entérites (GE) était définie selon les critères OMS. L’efficacité protectrice du vaccin contre les gastro-entérites sévères à rotavirus (RV) nécessitant une hospitalisation et/ou un traitement par réhydratation dans une structure médicale et l’efficacité spécifique du vaccin par génotype après 2 doses de Rotarix sont présentés dans le tableau ci-dessous :
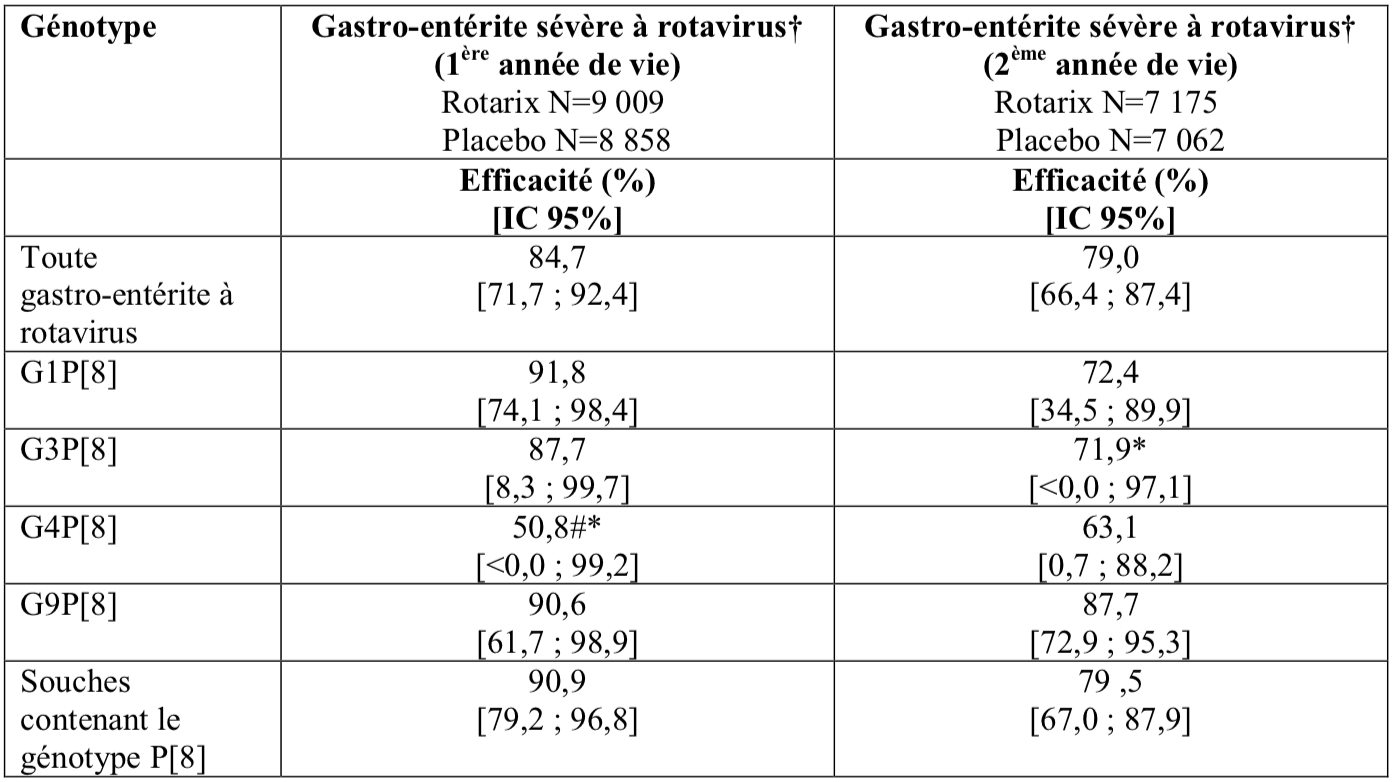

* Statistiquement non significatif (p ≥ 0,05). Ces données sont à interpréter avec précaution ;
# Le nombre de cas sur lequel repose l’estimation de l’efficacité contre le sérotype G4P[8] était faible (1 cas dans le groupe Rotarix et 2 cas dans le groupe placebo).
Une analyse poolée de 5 études d’efficacité * a estimé à 71,4 % (IC 95 % : 20,1 ; 91,1) l’efficacité contre les gastro-entérites sévères à rotavirus (score Vesikari ≥11) dues au rotavirus de génotype G2P[4] pendant la 1èreannée de vie.
1.3. Efficacité protectrice en Afrique
Une étude clinique réalisée en Afrique (Rotarix: N = 2 974; placebo: N = 1 443) a évalué Rotarix administré à des enfants âgés d’environ 10 et 14 semaines (2 doses) ou à des enfants âgés de 6, 10 et 14 semaines (3 doses). L'efficacité du vaccin contre les gastro-entérites graves à rotavirus au cours de la première année de vie était de 61,2 % (IC 95 % : 44,0 ; 73,2). L'efficacité protectrice du vaccin (mise en commun des doses) observée contre toutes gastro-entérites sévères à rotavirus est présentée dans le tableau suivant:
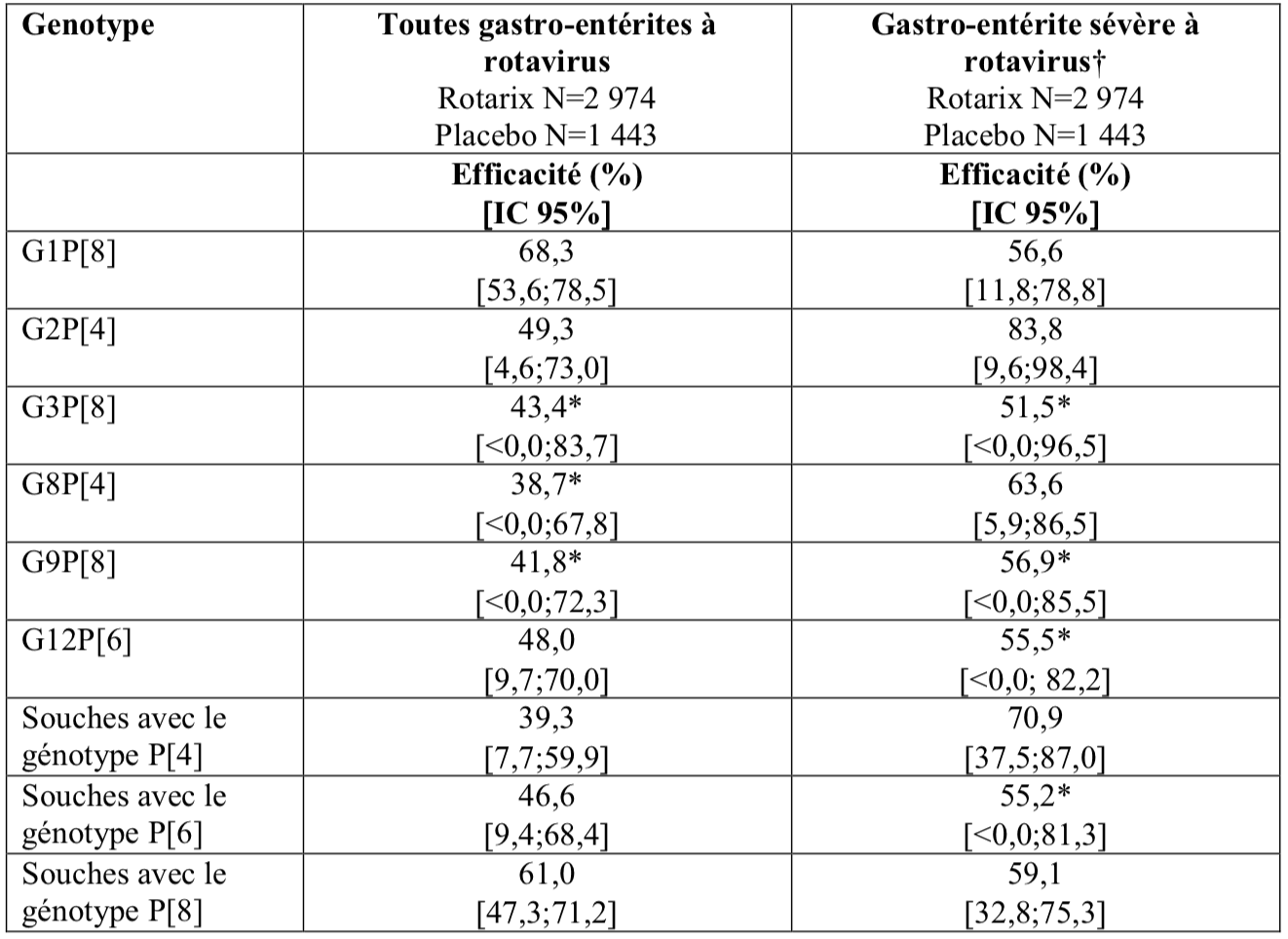

* Statistiquement non significatif (p ≥ 0,05). Ces données sont à interpréter avec précaution.
1.4. Efficacité jusqu’à l’âge de 3 ans en Asie
Une étude clinique menée en Asie (Hong Kong, Singapour et Taïwan) (cohorte total vaccinées : Rotarix: N = 5 359; placebo: N = 5 349) a évalué Rotarix selon des calendriers différents (2, 4 mois d'âge; 3, 4 mois d'âge).
Durant la première année, il y avait significativement moins de sujets dans le groupe Rotarix ayant présenté des gastro-entérites sévères à rotavirus dues à la circulation du rotavirus de type sauvagecomparés au groupe placebo pendant les 2 semaines après la 2ème dose jusqu’à un an d’âge (0,0 % contre 0,3 %) , avec une efficacité vaccinale de 100 % (IC 95 %: 72,2 ; 100).
L'efficacité protectrice du vaccin après deux doses de Rotarix observée contre les gastro-entérites sévères à rotavirus jusqu'à 2 ans d'âge est présentée dans le tableau suivant :
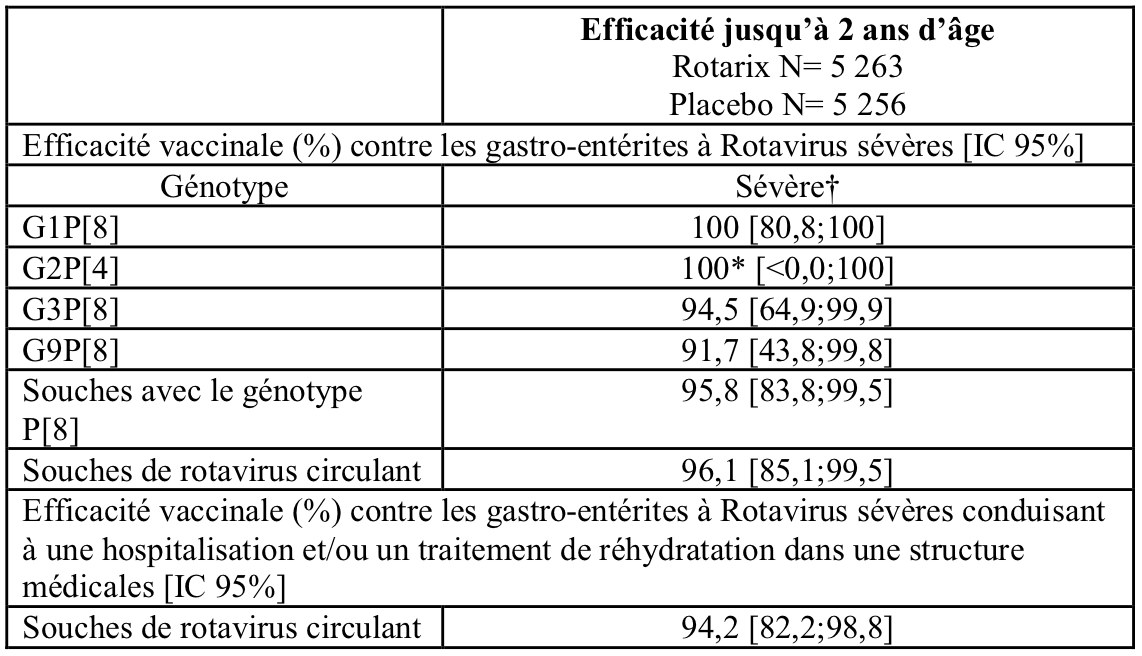

* Statistiquement non significatif (p.≥ 0,05). Ces données sont à interpréter avec précaution.
Durant la troisième année de vie, il n'y avait aucun cas de gastro-entérites sévères à RV dans le groupe Rotarix (N = 4 222) contre 13 (0,3%) dans le groupe placebo (N = 4 185). L'efficacité du vaccin était de 100 % (IC 95 % : 67,5 ; 100). Les cas de gastro-entérites sévères à RV étaient dus à des souches RV G1P[8], G2P[4], G3P[8] et G9P[8]. L'incidence des gastro-entérites sévères à RV associée à des génotypes individuels était trop faible pour permettre le calcul de l'efficacité. L'efficacité contre les gastro-entérites sévères à RV conduisant à une hospitalisation a été de 100 % (IC 95 % : 72,4 ; 100).
Efficacité protectrice de la formulation liquide
Etant donné que la réponse immunitaire observée après 2 doses de Rotarix formulation liquide était comparable à la réponse immunitaire observée après 2 doses de Rotarix formulation lyophilisée, l’efficacité vaccinale observée avec la formulation lyophilisée peut être transposée à la formulation liquide.
2. Réponse immunitaire
Le mécanisme immunologique selon lequel Rotarix protège contre les gastro-entérites à rotavirus n’est pas complètement connu. La relation entre les réponses en anticorps après vaccination contre le rotavirus et la protection conte les gastro-entérites à rotavirus n’a pas été établie.
Le tableau suivant montre le pourcentage de sujets initialement séronégatifs au rotavirus (taux en anticorps IgA < 20 U/mL) (par ELISA) ayant un taux sérique en anticorps IgA anti-rotavirus > 20 UI/mL 1 à 2 mois après la seconde dose de vaccin ou placebo, dans les différentes études réalisées avec Rotarix formulation lyophilisée.
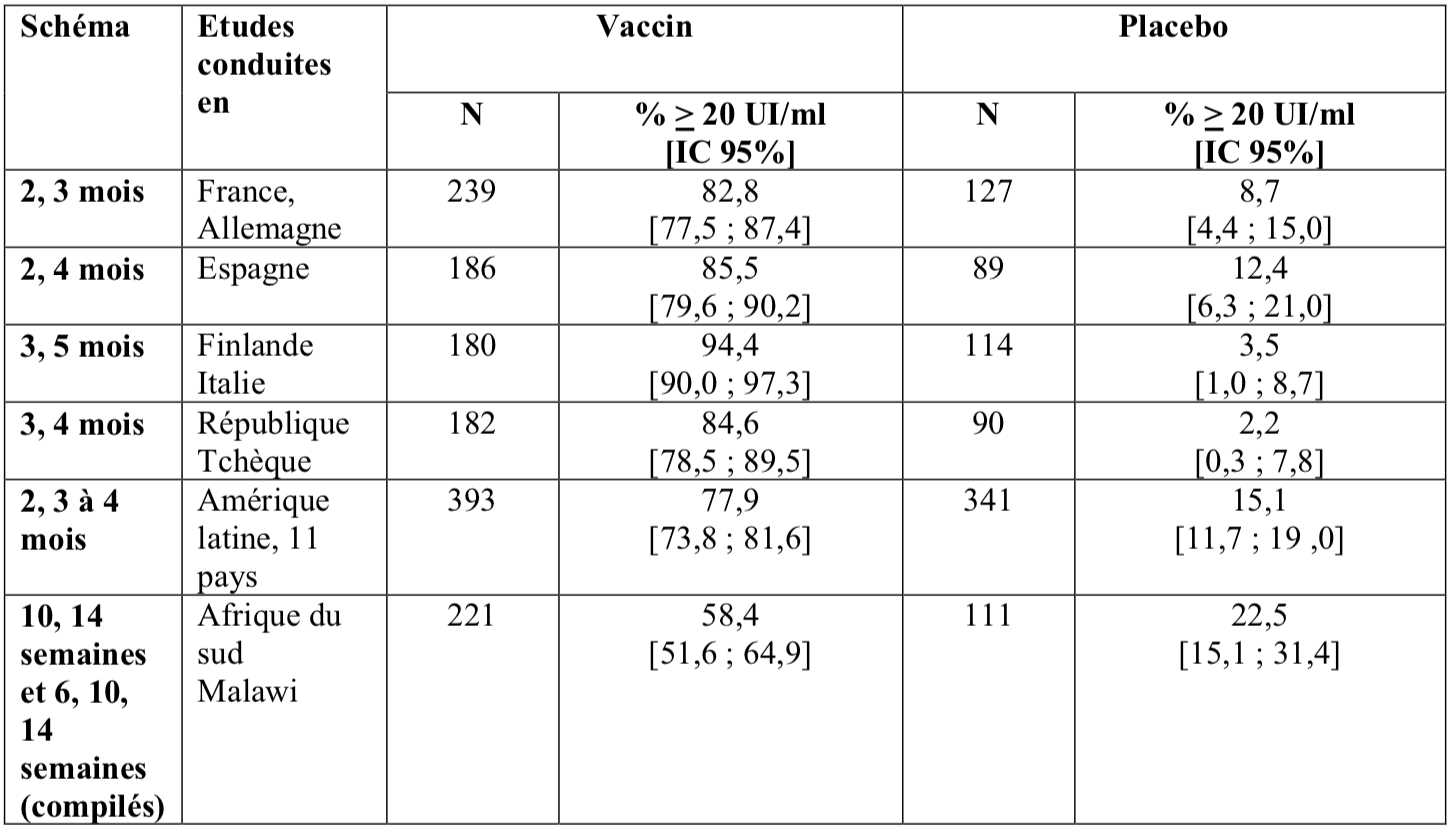

Réponse immunitaire chez les nourrissons nés prématurés
Dans une étude clinique réalisée chez des nourrissons nés prématurés, à 27 semaines de grossesse ou plus, l’immunogénicité de Rotarix a été évaluée dans un sous-groupe de 147 sujets et a montré que Rotarix est immunogène dans cette population ; 85,7 % (IC 95 % : 79,0 ; 90,9) des sujets ont atteint des titres sériques en anticorps IgA anti-rotavirus ≥ 20 UI/mL (par méthode ELISA), un mois après la seconde dose de vaccin.
3. Efficacité sur le terrain
Dans des études observationnelles, l’efficacité sur le terrain a été démontrée contre les gastro-entérites sévères conduisant à l’hospitalisation dues aux rotavirus de génotypes courants G1P[8], G2P[4], G3P[8], G4P[8] et G9P[8] et de génotypes moins courants G9P[4] and G9P[6]. Toutes ces souches sont en circulation à travers le monde.
Efficacité sur le terrain après 2 doses, dans la prévention des gastro-entérites à rotavirus conduisant à une hospitalisation



* Non statistiquement significatif (P ≥ 0,05). Ces données doivent être interprétées avec prudence ;
1 Le nombre de cas et de témoins complètement vaccinés (2 doses) ou non vaccinés est présenté ;
2 Etudes soutenues par GSK ;
3 Données issues d’une analyse post-hoc ;
4 L’efficacité sur le terrain du vaccin a été calculée en utilisant des témoins hospitalisés non infectés par le rotavirus (les estimations de l’étude réalisée à Taïwan ont été calculées en utilisant de façon combinée des témoins hospitalisés non infectés par le rotavirus et des témoins hospitalisés ne présentant pas de diarrhée) ;
5 L’efficacité sur le terrain du vaccin a été calculée en utilisant des témoins provenant du voisinage ;
6 Chez les sujets n’ayant pas reçu le schéma vaccinal complet, l’efficacité sur le terrain après une dose était comprise entre 51 % (IC 95 % : 26;67, au Salvador) et 60 % (IC 95 % : 37;75, au Brésil) ;
7 NA = non disponible. L’efficacité sur le terrain du vaccin est basée sur 41 cas ayant reçu le schéma vaccinal complet et sur 175 cas témoins ayant reçu le schéma vaccinal complet.
4. Impact sur la mortalité 1
Les études d’impact avec Rotarix menées au Panama, au Brésil et au Mexique ont montré une diminution de la mortalité pour diarrhée de toutes causes allant de 17 % à 73 % chez les enfants de moins de 5 ans, dans les 2 à 4 ans après l’introduction du vaccin.
5. Impact sur les hospitalisations 1
Dans une étude rétrospective de base de données menée en Belgique chez les enfants de 5 ans et moins, l'impact direct et indirect de la vaccination par Rotarix sur les hospitalisations liées au rotavirus allaient de 64 % (IC 95 %: 49; 76) à 80 % (IC 95 % : 77; 83) deux ans après l'introduction du vaccin. Des études similaires en Arménie, Australie, Brésil, Canada, Salvador et Zambie ont montré une réduction de 45 à 93 % entre 2 et 4 ans après l’introduction du vaccin.
De plus, neuf études d'impact sur les hospitalisations pour diarrhée de toutes causes menées en Afrique et Amérique latine ont montré une réduction de 14 % à 57 % entre 2 et 5 ans après l'introduction du vaccin.
Conservation
Durée de conservation :
- Applicateur prérempli pour administration orale : 3 ans
- Tube souple muni d’une membrane et d’un capuchon protecteur : 3 ans
- Présentation multidose de 5 tubes souples unidoses reliés par une plaque :2ans
Le vaccin doit être utilisé immédiatement après ouverture.
A conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler.
Conserver dans l'emballage extérieur d'origine, à l'abri de la lumière.
Manipulation
Le vaccin se présente sous la forme d’un liquide limpide, incolore, exempt de particules visibles, pour administration orale.
Le vaccin est prêt à l’emploi (aucune reconstitution ou dilution n’est requise).
Le vaccin doit être administré oralement et ne doit pas être mélangé à d’autres vaccins ou solutions.
Le vaccin doit être inspecté visuellement pour mettre en évidence la présence de toute particule étrangère et/ou changement de l'aspect physique avant administration. Dans l’un et/ou l’autre de ces cas, jetez le vaccin.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Instructions pour l’administration du vaccin avec l’applicateur prérempli pour administration orale : voir RCP (non commercialisé en France).
Instructions pour l’administration du vaccin en tube souple :
Veuillez lire les instructions d’utilisation jusqu’au bout avant d’administrer le vaccin.





Jetez le tube vide et le capuchon dans des conteneurs biologiques prévus à cet effet selon les recommandations locales.
Instructions pour l’administration du vaccin en présentation multidose de 5 tubes souples unidoses reliés par une plaque : voir RCP (non commercialisé en France).
L'administration du vaccin doit être consignée par le médecin sur le carnet de vaccination ou de santé avec le numéro de lot. Il peut aussi être inscrit par le patient ou son médecin sur un carnet de vaccination numérique (version grand public ou professionnelle).
Autres informations
Données de sécurité préclinique
Les données non cliniques issues des études conventionnelles de toxicologie en administration répétée n’ont pas révélé de risque particulier pour l’Homme.
Remboursement
Remboursé par l'assurance maladie à 65 % dans l'indication suivante :
"Immunisation active des nourrissons de l'âge de 6 semaines à 24 semaines pour la prévention des gastro-entérites dues à une infection à rotavirus, selon les recommandations en vigueur de la HAS datant du 23 juin 2022."