COMIRNATY KP.2 3 µg ENFANT (6 MOIS-4 ANS)
Laboratoire : BioNTech Manufacturing GmbH
Description
Vaccin à ARNm contre la covid 19, subvariant Omicron KP.2, 3 microgrammes/dose dispersion à diluer pour dispersion injectable. Autre nom : Cémivaméran.
Forme et Présentation
▼ Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté. Voir rubrique "Effets indésirables" pour les modalités de déclaration des effets indésirables.
Comirnaty KP.2 3 microgrammes/dose dispersion à diluer pour dispersion injectable
Dispersion à diluer pour dispersion injectable (stérile).
Le vaccin est une dispersion limpide à légèrement opalescente (pH : 6,9 - 7,9).
Nature et contenu de l’emballage extérieur
- 0,48 mL de dispersion à diluer dans un flacon multidose transparent de 2 mL (verre de type I) muni d’un bouchon (caoutchouc synthétique bromobutyle) et d’un couvercle amovible en plastique jaune avec opercule en aluminium. Chaque flacon contient 3 doses (voir rubrique "Manipulation").
Présentation : 10 flacons
Composition
Le médicament est fourni dans un flacon multidose avec un couvercle jaune et doit être dilué avant utilisation.
Un flacon (0,48 mL) contient 3 doses de 0,3 mL après dilution (voir rubriques "Posologie" et "Manipulation").
Une dose (0,3 mL) contient :
1. Antigène
- 3 microgrammes de cémivaméran *, un vaccin à ARNm contre la covid 19 (à nucléoside modifié, encapsulé dans des nanoparticules lipidiques).
2. Excipients
- ((4-hydroxybutyl)azanediyl)bis(hexane-6,1-diyl)bis(2-hexyldécanoate) (ALC-0315)
- 2-[(polyéthylène glycol)-2000]-N,N-ditétradécylacétamide (ALC-0159)
- 1,2-Distéaroyl-sn-glycéro-3-phosphocholine (DSPC)
- Cholestérol
- Trométamol
- Chlorhydrate de trométamol
- Saccharose
En savoir plus : article général sur les vaccins à ARN.
Indications
Comirnaty KP.2 dispersion à diluer pour dispersion injectable est indiqué pour l’immunisation active pour la prévention de la covid 19 causée par le SARS-CoV-2 chez les nourrissons et les enfants âgés de 6 mois à 4 ans.
L’utilisation de ce vaccin doit être conforme aux recommandations officielles.
Posologie
Nourrissons et enfants âgés de 6 mois à 4 ans qui n’ont pas encore reçu de primo-vaccination complète contre la covid 19 et n’ont pas d’antécédents d’infection par le SARS‑CoV‑2.
Comirnaty KP.2 3 microgrammes/dose dispersion à diluer pour dispersion injectable doit être administré par voie intramusculaire, après dilution, selon un schéma de primo-vaccination en 3 doses. Il est recommandé d’administrer la seconde dose 3 semaines après la première dose, puis d’administrer la troisième dose au moins 8 semaines après la seconde dose (voir rubriques "Mises en garde et précautions d'emploi" et "Pharmacodynamie").
Si l’enfant atteint l’âge de 5 ans entre les doses du schéma de primo-vaccination, il/elle devra recevoir la même dose de 3 microgrammes pour compléter le schéma de primo-vaccination.
Nourrissons et enfants âgés de 6 mois à 4 ans qui ont déjà reçu une primo-vaccination complète contre la covid 19 ou qui ont des antécédents d’infection par le SARS‑CoV‑2
Comirnaty KP.2 3 microgrammes/dose dispersion à diluer pour dispersion injectable doit être administré par voie intramusculaire, après dilution, en une dose unique chez les nourrissons et les enfants âgés de 6 mois à 4 ans.
Chez les personnes qui ont déjà reçu un vaccin contre la covid 19, Comirnaty KP.2 doit être administré au moins 3 mois après la dose la plus récente d’un vaccin contre la covid 19.
Enfants sévèrement immunodéprimés âgés de 6 mois à 4 ans
Des doses supplémentaires peuvent être administrées chez les personnes sévèrement immunodéprimées, conformément aux recommandations nationales (voir rubrique "Mises en garde et précautions d'emploi").
Interchangeabilité
Pour la primo-vaccination avec Comirnaty KP.2 3 microgrammes/dose, il est possible d’utiliser n’importe quelle version, passée ou présente, du vaccin Comirnaty, mais le nombre total de doses nécessaires à la primo-vaccination ne doit pas être dépassé. Le schéma de primo-vaccination ne doit être administré qu’une seule fois.
L’interchangeabilité de Comirnaty avec les vaccins contre la covid 19 des autres fabricants n’a pas été établie.
Population pédiatrique
Des formulations pédiatriques sont disponibles pour les enfants âgés de 5 à 11 ans. Pour plus de précisions, veuillez vous reporter au Résumé des caractéristiques du produit de ces autres formulations.
La sécurité et l’efficacité du vaccin chez les nourrissons âgés de moins de 6 mois n’ont pas encore été établies.
Mode d'administration
Comirnaty KP.2 3 microgrammes/dose dispersion à diluer pour dispersion injectable doit être administré par voie intramusculaire après dilution (voir rubrique "Manipulation").
Après dilution, les flacons de Comirnaty KP.2 avec un couvercle jaune contiennent 3 doses de 0,3 mL de vaccin. Des aiguilles et seringues classiques peuvent être utilisées pour extraire les 3 doses d’un flacon unique. Indépendamment du type de seringue et d’aiguille :
- Chaque dose doit contenir 0,3 mL de vaccin.
- Si la quantité de vaccin restant dans le flacon ne permet pas d’obtenir une dose complète de 0,3 mL, jeter le flacon et la solution résiduelle.
- Ne pas regrouper les résidus de solution provenant de plusieurs flacons.
Chez les nourrissons âgés de 6 à moins de 12 mois, il est recommandé d’effectuer l’injection dans la face antérolatérale de la cuisse. Chez les enfants âgés de 1 an et plus, il est recommandé d’effectuer l’injection dans la face antérolatérale de la cuisse ou dans le muscle deltoïde.
Ne pas injecter le vaccin par voie intraveineuse, sous-cutanée ou intradermique.
Le vaccin ne doit pas être mélangé dans la même seringue avec d’autres vaccins ou médicaments.
Pour les précautions à prendre avant l’administration du vaccin, voir rubrique "Mises en garde et précautions d'emploi".
Pour les instructions concernant la décongélation, la manipulation et l’élimination du vaccin, voir la rubrique "Manipulation".
Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique "Composition".
Selon le Décret n° 2021-1059 du 7 août 2021, modifié par le Décret n° 2021-1413 du 29 octobre 2021, les cas de contre-indication médicale faisant obstacle à la vaccination contre la covid 19 sont les suivants.
1° Contre-indications inscrites dans le résumé des caractéristiques du produit
- Antécédent d’allergie documentée (avis allergologue) à un des composants du vaccin en particulier polyéthylène-glycols et par risque d’allergie croisée aux polysorbates.
- Réaction anaphylaxique au moins de grade 2 (atteinte au moins de 2 organes) à une première injection d’un vaccin contre la covid posée après expertise allergologique.
- Personnes ayant déjà présenté des épisodes de syndrome de fuite capillaire (contre-indication commune au vaccin Vaxzevria et au vaccin Janssen).
- Personnes qui ont présenté un syndrome thrombotique et thrombocytopénique (STT) suite à la vaccination par Vaxzevria.
2° Recommandation médicale de ne pas initier une vaccination (première dose)
- Syndrome inflammatoire multi systémique pédiatrique (PIMS) post covid 19.
- Myocardites ou myo-péricardites associées à une infection par SARS-CoV-2.
3° Une recommandation établie après concertation médicale pluridisciplinaire de ne pas effectuer la seconde dose de vaccin suite à la survenue d'un effet indésirable d'intensité sévère ou grave attribué à la première dose de vaccin signalé au système de pharmacovigilance (par exemple : la survenue de myocardite, de syndrome de Guillain-Barré…).
4° Une recommandation établie par un Centre de Référence Maladies Rares (CRMR) ou un Centre de Compétence Maladies Rares (CCMR) après concertation médicale pluridisciplinaire (avis collégial) de ne pas initier la vaccination contre la covid 19.
5° Situations de contre-indication temporaire à la vaccination contre la covid 19
- Traitement par anticorps monoclonaux anti-SARS-CoV-2.
- Myocardites ou péricardites d’étiologie non liée à une infection par SARS-CoV-2, survenues antérieurement à la vaccination et toujours évolutives.
La procédure à suivre en cas de contre-indication à la vaccination contre la covid 19 est indiquée sur le site de l'assurance maladie. Le certificat de contre-indication (cerfa n° 16183*02) peut être délivré par tout médecin, généraliste ou spécialiste, inscrit à l'Ordre. Il permet de déroger à l'obligation vaccinale professionnelle.
Mises en garde et précautions d'emploi
Traçabilité
Afin d’améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Recommandations générales
Hypersensibilité et anaphylaxie
Des cas d’anaphylaxie ont été rapportés. Il convient de toujours disposer d’un traitement médical approprié et de surveiller le sujet vacciné en cas de survenue d’une réaction anaphylactique suite à l’administration du vaccin.
Voir fiche sur la conduite à tenir en cas d'anaphylaxie.
Il est recommandé de surveiller attentivement les sujets vaccinés pendant au moins 15 minutes après la vaccination. Aucune dose supplémentaire du vaccin ne doit être administrée chez les personnes ayant présenté une réaction anaphylactique après une précédente dose de Comirnaty.
Recommandations de la Haute Autorité de santé, de la Société de pathologie infectieuse de langue française et de la Fédération française d'allergologie
La vaccination est contre-indiquée aux personnes ayant des antécédents d’hypersensibilité à l’un des composants du vaccin, en particulier au polyéthylène glycol (PEG), ou qui ont un antécédent d’allergie au polysorbate ou à la trométhamine (TRIS, trométamol) car il existe un risque d’allergie croisée avec le PEG contenu dans le vaccin. Le PEG est le constituant du macrogol et est présent dans différents médicaments parentéraux. On peut également le trouver dans l'enrobage de nombreux traitements (antibiotiques et AINS en particulier) ; dans la situation d’une réaction à ces traitements, l'allergène est exceptionnellement le PEG.
Au vu des données rassurantes depuis le lancement de la campagne à l’échelle mondiale, la Fédération française d'allergologie a recommandé que les antécédents d’allergie ou d’anaphylaxie ne constituent pas une contre-indication systématique à cette vaccination. La conduite à tenir devrait tenir compte de la description de l’allergie, de la substance en cause ou potentiellement en cause et des conclusions d’un éventuel bilan allergologique :
- anaphylaxie prouvée au PEG, au polysorbate ou à la trométhamine : pas de vaccination par un vaccin à ARNm (utiliser le vaccin d'AstraZeneca si possible) ;
- antécédent d’anaphylaxie à un traitement contenant du PEG, du polysorbate ou de la trométhamine, et bilan allergologique d’imputabilité non fait : vaccination différée en attendant le bilan allergologique, sauf vaccination particulièrement nécessaire ;
- antécédent de réaction immédiate sans signe de gravité à un médicament ou une autre substance dont l’enrobage contient du polysorbate (par exemple urticaire isolée ou œdème du visage sans œdème laryngé après une prise de Ciflox®) : vaccination puis surveillance prolongée (30 minutes) ;
- antécédent de réaction d’allure allergique tardive (survenant au-delà de deux heures) au PEG, au polysorbate, à la trométhamine ou à une autre substance : vaccination et surveillance « standard » (15 minutes) ;
- antécédent d’anaphylaxie à un médicament connu avec identification de l'allergène (différent du PEG ou du polysorbate) après bilan allergologique : vaccination puis surveillance prolongée (30 minutes).
En pratique, l'administration d’un vaccin à ARNm doit avoir lieu dans une structure capable de prendre en charge une réaction d’hypersensibilité immédiate grave. Toutes les personnes vaccinées doivent être observées pendant 15 minutes (ou plus selon les antécédents). En cas de réaction allergique grave ou immédiate après la 1ère dose du vaccin, la deuxième est contre-indiquée.
Voir également les rubriques "Composition", "Contre-indications" et "Effets indésirables".
Myocardite et péricardite
Il existe un risque accru de myocardite et de péricardite après vaccination par Comirnaty. Ces pathologies peuvent se développer en l’espace de quelques jours seulement après la vaccination et sont survenues principalement dans les 14 jours. Elles ont été observées plus souvent après la seconde vaccination, et plus souvent chez des hommes plus jeunes (voir rubrique "Effets indésirables"). Les données disponibles indiquent que la plupart des cas se sont résolus. Certains cas ont nécessité un soin médical intensif et des cas d’issue fatale ont été observés.
Les professionnels de santé doivent être attentifs aux signes et symptômes de myocardite et de péricardite. Les sujets vaccinés (parents ou aidants inclus) doivent être informés qu'ils doivent immédiatement consulter un médecin s'ils développent des symptômes révélateurs d'une myocardite ou d'une péricardite, tels que des douleurs thoraciques (aiguës et persistantes), un essoufflement ou des palpitations après la vaccination.
Les professionnels de santé doivent consulter les recommandations et/ou des spécialistes pour diagnostiquer et traiter cette affection.
Réactions liées à l’anxiété
Des réactions liées à l’anxiété, dont des réactions vasovagales (syncope), une hyperventilation ou des réactions liées au stress (sensation vertigineuse, palpitations, augmentation de la fréquence cardiaque, modifications de la pression artérielle, paresthésie, hypoesthésie et transpiration, par exemple) peuvent survenir lors de l’acte vaccinal. Les réactions liées au stress sont transitoires et disparaissent spontanément. Les personnes doivent être informées qu’elles doivent consulter le médecin vaccinateur si elles développent de tels symptômes. Il est important que des précautions soient prises afin d’éviter toute blessure en cas d’évanouissement.
Affections concomitantes
La vaccination doit être reportée chez les personnes présentant une affection fébrile sévère aiguë ou une infection aiguë. La présence d’une infection mineure et/ou d’une fièvre peu élevée ne doit pas retarder la vaccination.
Thrombopénie et troubles de la coagulation
Comme pour les autres injections intramusculaires, le vaccin devra être administré avec prudence chez les personnes recevant un traitement anticoagulant ou présentant une thrombopénie ou tout autre trouble de la coagulation (hémophilie, par exemple) car un saignement ou une ecchymose peut survenir après administration intramusculaire chez ces personnes.
Personnes immunodéprimées
La sécurité et l’immunogénicité ont été évaluées chez un nombre limité de personnes immunodéprimées, notamment de personnes sous traitement immunosuppresseur (voir rubriques "Effets indésirables" et "Pharmacodynamie"). L’efficacité de Comirnaty KP.2 peut être diminuée chez les sujets immunodéprimés.
Durée de protection
La durée de protection conférée par le vaccin n’est pas établie et est toujours en cours d’évaluation dans les essais cliniques.
Limites de l’efficacité du vaccin
Comme avec tout vaccin, il est possible que les personnes vaccinées par Comirnaty KP.2 ne soient pas toutes protégées. Un délai de 7 jours après la vaccination peut être nécessaire avant que les personnes vaccinées soient protégées de façon optimale.
Interactions
Aucune étude d’interaction n’a été réalisée.
L’administration concomitante de Comirnaty KP.2 avec d’autres vaccins n’a pas été étudiée.
Fertilité
Comirnaty KP.2 3 microgrammes/dose dispersion à diluer pour dispersion injectable n’est pas destiné à être utilisé chez les personnes âgées de plus de 5 ans.
Pour plus de précisions sur l’utilisation du vaccin chez les personnes âgées de plus de 5 ans, veuillezvous reporter au Résumé des caractéristiques du produit des autres formulations.
Grossesse
Comirnaty KP.2 3 microgrammes/dose dispersion à diluer pour dispersion injectable n’est pas destiné à être utilisé chez les personnes âgées de plus de 5 ans.
Pour plus de précisions sur l’utilisation du vaccin chez les personnes âgées de plus de 5 ans, veuillezvous reporter au Résumé des caractéristiques du produit des autres formulations.
Allaitement
Comirnaty KP.2 3 microgrammes/dose dispersion à diluer pour dispersion injectable n’est pas destiné à être utilisé chez les personnes âgées de plus de 5 ans.
Pour plus de précisions sur l’utilisation du vaccin chez les personnes âgées de plus de 5 ans, veuillezvous reporter au Résumé des caractéristiques du produit des autres formulations.
Effets indésirables
1. Résumé du profil de sécurité
La sécurité de Comirnaty KP.2 est extrapolée à partir des données de sécurité relatives aux précédents vaccins Comirnaty.
1.1. Vaccin Comirnaty initialement approuvé
Nourrissons âgés de 6 à 23 mois – après 3 doses
Dans une analyse de l’étude 3 (phase 2/3), 2 176 nourrissons (1 458 ayant reçu le vaccin Comirnaty 3 microgrammes initialement approuvé et 718 ayant reçu le placebo) étaient âgés de 6 à 23 mois. D’après les données de la période de suivi en aveugle, contrôlé contre placebo, jusqu’à la date limite du 28 février 2023, 720 nourrissons âgés de 6 à 23 mois ayant reçu les 3 doses du schéma de primo-vaccination (483 vaccinés par Comirnaty 3 microgrammes et 237 ayant reçu le placebo) ont été suivis pendant une durée médiane de 1,7 mois après la troisième dose.
Les effets indésirables les plus fréquents, chez les nourrissons âgés de 6 à 23 mois ayant reçu une dose quelconque du schéma de primo-vaccination, étaient une irritabilité (> 60 %), une somnolence (> 40 %), une diminution de l’appétit (> 30 %), une sensibilité au site d’injection (> 20 %), une rougeur au site d’injection et une fièvre (> 10 %).
Enfants âgés de 2 à 4 ans – après 3 doses
Dans une analyse de l’étude 3 (phase 2/3), 3 541 enfants (2 368 vaccinés par Comirnaty 3 microgrammes et 1 173 ayant reçu le placebo) étaient âgés de 2 à 4 ans. D’après les données de la période de suivi en aveugle, contrôlé contre placebo, jusqu’à la date limite du 28 février 2023, 1 268 enfants âgés de 2 à 4 ans ayant reçu les 3 doses du schéma de primo-vaccination (863 vaccinés par Comirnaty 3 microgrammes et 405 ayant reçu le placebo) ont été suivis pendant une durée médiane de 2,2 mois après la troisième dose.
Les effets indésirables les plus fréquents, chez les enfants âgés de 2 à 4 ans ayant reçu une dose quelconque du schéma de primo-vaccination, étaient une douleur au site d’injection et une fatigue (> 40 %), une rougeur au site d’injection et une fièvre (> 10 %).
Enfants âgés de 5 à 11 ans (c.-à-d. de 5 à moins de 12 ans) – après 2 doses
Durant l’étude 3, un total de 3 109 enfants âgés de 5 à 11 ans ont reçu au moins 5 à 11 ans ont reçu un placebo. Au moment de l’analyse de l’étude 3 de phase 2/3 portant sur les données recueillies jusqu’à la date limite du 20 mai 2022, 2 206 enfants (1 481 vaccinés par Comirnaty 10 microgrammes et 725 ayant reçu le placebo) avaient été suivis pendant ≥ 4 mois après la deuxième dose durant la phase de suivi en aveugle contrôlée contre placebo. L’évaluation de la sécurité dans l’étude 3 est toujours en cours.
Le profil de sécurité global de Comirnaty chez les participants de 5 à 11 ans a été similaire à celui observé chez les participants âgés de 16 ans et plus. Les effets indésirables les plus fréquents chez les enfants âgés de 5 à 11 ans ayant reçu 2 doses étaient une douleur au site d’injection (> 80 %), une fatigue (> 50 %), des céphalées (> 30 %), une rougeur et un gonflement au site d’injection (≥ 20 %), des myalgies, des frissons et une diarrhée (> 10 %).
Enfants âgés de 5 à 11 ans (c.-à-d. de 5 à moins de 12 ans) – après la dose de rappel
Un sous-groupe des participants de l’étude 3, constitué de 2 408 enfants âgés de 5 à 11 ans, a reçu une dose de rappel de Comirnaty 10 microgrammes au moins 5 mois (intervalle : 5,3 à 19,4 mois) après un schéma de primo-vaccination complet. L’analyse du sous-groupe de l’étude 3 de phase 2/3 porte sur les données recueillies jusqu’à la date limite de prise en compte, le 28 février 2023 (durée de suivi médiane de 6,4 mois).
Le profil de sécurité global de la dose de rappel a été similaire à celui observé après le schéma de primo-vaccination. Les effets indésirables les plus fréquents chez les enfants âgés de 5 à 11 ans après la dose de rappel étaient une douleur au site d’injection (> 60 %), une fatigue (> 30 %), des céphalées (> 20 %), des myalgies, des frissons, une rougeur et un gonflement au site d’injection (> 10 %).
Adolescents âgés de 12 à 15 ans – après 2 doses
Dans une analyse du suivi à long terme de la sécurité dans l’étude 2, 2 260 adolescents (1 131 vaccinés par Comirnaty et 1 129 ayant reçu le placebo) étaient âgés de 12 à 15 ans. Parmi ces derniers, 1 559 adolescents (786 vaccinés par Comirnaty et 773 ayant reçu le placebo) ont été suivis pendant ≥ 4 mois après avoir reçu la seconde dose.
Le profil de sécurité global de Comirnaty chez les adolescents de 12 à 15 ans a été similaire à celui observé chez les participants âgés de 16 ans et plus. Les effets indésirables les plus fréquents, chez les adolescents de 12 à 15 ans ayant reçu 2 doses, étaient une douleur au site d’injection (> 90 %), une fatigue et des céphalées (> 70 %), des myalgies et des frissons (> 40 %), des arthralgies et une fièvre (> 20 %).
Participants âgés de 16 ans et plus – après 2 doses
Durant l’étude 2, un total de 22 026 participants âgés de 16 ans et plus ont reçu au moins 1 dose de Comirnaty 30 microgrammes et un total de 22 021 participants âgés de 16 ans et plus ont reçu un placebo (dont 138 et 145 adolescents de 16 ou 17 ans, dans les groupes vaccin et placebo respectivement). Un total de 20 519 participants âgés de 16 ans et plus ont reçu 2 doses de Comirnaty.
Au moment de l’analyse de l’étude 2, à la date du 13 mars 2021 où les données ont cessé d’être prises en compte concernant les participants suivis en double aveugle, contrôlés contre placebo jusqu’à la date de levée de l’aveugle, un total de 25 651 (58,2 %) participants (13 031 vaccinés par Comirnaty et 12 620 ayant reçu le placebo) âgés de 16 ans et plus ont été suivis pendant ≥ 4 mois après la seconde dose. Parmi ces derniers, un total de 15 111 participants (7 704 vaccinés par Comirnaty et 7 407 ayant reçu le placebo) étaient âgés de 16 à 55 ans et un total de 10 540 (5 327 vaccinés par Comirnaty et 5 213 ayant reçu le placebo) étaient âgés de 56 ans et plus.
Les effets indésirables les plus fréquents, chez les participants âgés de 16 ans et plus ayant reçu 2 doses, étaient une douleur au site d’injection (> 80 %), une fatigue (> 60 %), des céphalées (> 50 %), des myalgies (> 40 %) et des frissons (> 30 %), des arthralgies (> 20 %), une fièvre et un gonflement au site d’injection (> 10 %). Ces effets ont été généralement d’intensité légère ou modérée et se sont résolus en quelques jours après la vaccination. Une moindre fréquence de la réactogénicité a été observée chez les sujets les plus âgés.
Le profil de sécurité chez les 545 participants âgés de 16 ans et plus ayant reçu Comirnaty et séropositifs au SARS-CoV-2 à l’inclusion était identique à celui observé dans le reste de la population.
Participants âgés de 12 ans et plus – après la dose de rappel
Un sous-groupe des participants de l’étude 2 de phase 2/3, constitué de 306 adultes âgés de 18 à 55 ans ayant reçu les 2 doses du schéma de primo-vaccination par Comirnaty, a reçu une dose de rappel de Comirnaty 6 mois environ (intervalle : 4,8 à 8,0 mois) après la deuxième dose. Globalement, à la date de l’analyse des données (22 novembre 2021), la durée médiane de suivi des participants ayant reçu une dose de rappel était de 8,3 mois (intervalle : 1,1 à 8,5 mois) et 301 participants avaient été suivis pendant ≥ 6 mois après la dose de rappel.
Le profil de sécurité global de la dose de rappel a été similaire à celui observé après les 2 premières doses. Les effets indésirables les plus fréquents, chez les participants âgés de 18 à 55 ans, étaient une douleur au site d’injection (> 80 %), une fatigue (> 60 %), des céphalées (> 40 %), des myalgies (> 30 %), des frissons et des arthralgies (> 20 %).
Dans l’étude 4, une étude contrôlée contre placebo portant sur la dose de rappel, des participants âgés de 16 ans et plus recrutés dans l’étude 2 ont reçu une dose de rappel de Comirnaty (5 081 participants) ou un placebo (5 044 participants) au moins 6 mois après la deuxième dose de Comirnaty. Globalement, à la date de l’analyse des données (8 février 2022), la durée médiane de suivi des participants ayant reçu une dose de rappel était de 2,8 mois (intervalle : 0,3 à 7,5 mois) après la dose de rappel pendant la phase de suivi en aveugle contrôlée contre placebo. Parmi ces derniers, 1 281 participants (895 vaccinés par Comirnaty et 386 ayant reçu le placebo) ont été suivis pendant ≥ 4 mois après la dose de rappel. Aucun nouvel effet indésirable de Comirnaty n’a été identifié.
Un sous-groupe des participants de l’étude 2 de phase 2/3, constitué de 825 adolescents âgés de 12 à 15 ans ayant reçu les 2 doses du schéma de primo-vaccination par Comirnaty, a reçu une dose de rappel de Comirnaty 11,2 mois environ (intervalle : 6,3 à 20,1 mois) après la deuxième dose. Globalement, d’après les données recueillies jusqu’à la date de l’analyse (3 novembre 2022), la durée médiane de suivi des participants ayant reçu une dose de rappel était de 9,5 mois (intervalle : 1,5 à 10,7 mois). Aucun nouvel effet indésirable de Comirnaty n’a été identifié.
Dose de rappel après une primo-vaccination par un autre vaccin autorisé contre la covid 19
Dans 5 études indépendantes sur l’utilisation d’une dose de rappel de Comirnaty chez des personnes qui avaient reçu une primo-vaccination complète par un autre vaccin autorisé contre la covid 19 (dose de rappel hétérologue), aucun nouveau problème de sécurité n’a été identifié (voir rubrique "Pharmacodynamie").
1.2. Version de Comirnaty adaptée à Omicron
Nourrissons âgés de 6 à 23 mois – après une dose de rappel (quatrième dose)
Dans 2 groupes de l’étude 6 (phase 3, groupes 2 et 3), 160 participants (groupe 2 : 92 ; groupe 3 : 68) âgés de 6 à 23 mois qui avaient déjà reçu 3 doses de Comirnaty ont reçu une dose de rappel (quatrième dose) de Comirnaty Original/Omicron BA.4‑5 (1,5/1,5 microgrammes) 2,1 à 8,6 mois après avoir reçu la troisième dose dans le groupe 2 et 3,8 à 12,5 mois après avoir reçu la troisième dose dans le groupe 3. Pour les participants ayant reçu une dose de rappel (quatrième dose) de Comirnaty Original/Omicron BA.4‑5, la durée de suivi médiane a été de 4,4 mois dans le groupe 2 et de 6,4 mois dans le groupe 3.
Le profil de sécurité global de la dose de rappel (quatrième dose) de Comirnaty Original/Omicron BA.4‑5 a été similaire à celui observé après 3 doses. Les effets indésirables les plus fréquents, chez les participants âgés de 6 à 23 mois, étaient une irritabilité (> 30 %), une diminution de l’appétit (> 20 %), une somnolence, une sensibilité au site d’injection et une fièvre (> 10 %).
Enfants âgés de 2 à 4 ans – après une dose de rappel (quatrième dose)
Dans 2 groupes de l’étude 6 (phase 3, groupes 2 et 3), 1 207 participants (groupe 2 : 218 ; groupe 3 : 989) âgés de 2 à 4 ans qui avaient déjà reçu 3 doses de Comirnaty ont reçu une dose de rappel (quatrième dose) de Comirnaty Original/Omicron BA.4‑5 (1,5/1,5 microgrammes) 2,1 à 8,6 mois après avoir reçu la troisième dose dans le groupe 2 et 2,8 à 17,5 mois après avoir reçu la troisième dose dans le groupe 3. Pour les participants ayant reçu une dose de rappel (quatrième dose) de Comirnaty Original/Omicron BA.4‑5, la durée de suivi médiane a été de 4,6 mois dans le groupe 2 et de 6,3 mois dans le groupe 3.
Le profil de sécurité global de la dose de rappel (quatrième dose) de Original/Omicron BA.4‑5 a été similaire à celui observé après 3 doses. Les effets indésirables les plus fréquents, chez les participants âgés de 2 à 4 ans, étaient une douleur au site d’injection (> 30 %) et une fatigue (> 20 %).
Enfants âgés de 5 à 11 ans (c.-à-d. de 5 à moins de 12 ans) – après une dose de rappel (quatrième dose)
Dans un sous-groupe de l’étude 6 (phase 3), 113 participants âgés de 5 à 11 ans qui avaient déjà reçu 3 doses de Comirnaty ont reçu une dose de rappel (quatrième dose) de Comirnaty Original/Omicron BA.4-5 (5/5 microgrammes) 2,6 à 8,5 mois après avoir reçu la troisième dose. Pour les participants ayant reçu une dose de rappel (quatrième dose) de Comirnaty Original/Omicron BA.4-5, la durée de suivi médiane a été de 6,3 mois.
Le profil de sécurité global de la dose de rappel (quatrième dose) de Comirnaty Original/Omicron BA.4-5 a été similaire à celui observé après 3 doses. Les effets indésirables les plus fréquents, chez les participants âgés de 5 à 11 ans, étaient une douleur au site d’injection (> 60 %), une fatigue (> 40 %), des céphalées (> 20 %) et des myalgies (> 10 %).
Participants âgés de 12 ans et plus – après une dose de rappel de Comirnaty Original/Omicron BA.4-5 (quatrième dose)
Dans un sous-groupe de l’étude 5 (phase 2/3), 107 participants âgés de 12 à 17 ans, 313 participants âgés de 18 à 55 ans et 306 participants âgés de 56 ans et plus qui avaient déjà reçu 3 doses de Comirnaty ont reçu une dose de rappel (quatrième dose) de Comirnaty Original/Omicron BA.4-5 (15/15 microgrammes) 5,4 à 16,9 mois après avoir reçu la troisième dose. Pour les participants ayant reçu une dose de rappel (quatrième dose) de Comirnaty Original/Omicron BA.4-5, la durée de suivi médiane a été d’au moins 1,5 mois.
Le profil de sécurité global de la dose de rappel (quatrième dose) de Original/Omicron BA.4-5 a été similaire à celui observé après 3 doses. Les effets indésirables les plus fréquents, chez les participants âgés de 12 ans et plus, étaient une douleur au site d’injection (> 60 %), une fatigue (> 50 %), des céphalées (> 40 %), des myalgies (> 20 %), des frissons (> 10 %) et des arthralgies (> 10 %).
Tableau récapitulatif des effets indésirables observés dans les études cliniques sur Comirnaty et Comirnaty Original/Omicron BA.4-5 et dans le cadre de la surveillance de Comirnaty après l’autorisation chez les personnes âgées de 5 ans et plus.
Les effets indésirables observés au cours des études cliniques et après la mise sur le marché sont présentés ci-dessous par catégories de fréquence, définies comme suit :
- très fréquent (≥ 1/10),
- fréquent (≥ 1/100, < 1/10),
- peu fréquent (≥ 1/1 000, < 1/100),
- rare (≥ 1/10 000, < 1/1 000),
- très rare (< 1/10 000),
- fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Effets indésirables observés au cours des essais cliniques de Comirnaty et de Comirnaty Original/Omicron BA.4‑5 et dans le cadre de la surveillance de Comirnaty après l’autorisation chez les personnes âgées de 6 mois et plus.
Affections hématologiques et du système lymphatique
- Fréquent : lymphadénopathie a.
Affections du système immunitaire
- Peu fréquent : réactions d’hypersensibilité (par exemple : rash, prurit, urticaire b, angio-œdème b).
- Fréquence indéterminée : anaphylaxie.
Troubles du métabolisme et de la nutrition
- Peu fréquent : diminution de l’appétit j.
Affections psychiatriques
- Très fréquent : irritabilité k.
- Peu fréquent : insomnies.
Affections du système nerveux
- Très fréquent : céphalées, somnolence k.
- Peu fréquent : sensations vertigineuses d ; léthargie.
- Rare : paralysie faciale périphérique aiguë c.
- Fréquence indéterminée : paresthésie d ; hypoesthésie d.
Affections cardiaques
- Très rare : myocardite d ; péricardite d.
Affections gastro-intestinales
- Très fréquent : diarrhée d.
- Fréquent : nausées ; vomissements d, m.
Affections de la peau et du tissu sous-cutané
- Peu fréquent : hyperhidrose, sueurs nocturnes
- Fréquence indéterminée : érythème polymorphe d.
Affections musculo-squelettiques et systémiques
- Très fréquent : arthralgies ; myalgies.
- Peu fréquent : douleur dans les extrémités e.
Affections des organes de reproduction et du sein
- Fréquence indéterminée : saignements menstruels importants i.
Troubles généraux et anomalies au site d’administration
- Très fréquent : douleur au site d’injection ; sensibilité au site d’injection k ; fatigue ; frissons ; fièvre f ; gonflement au site d’injection.
- Fréquent : rougeur au site d’injection h.
- Peu fréquent : asthénie ; malaise ; prurit au site d’injection.
- Fréquence indéterminée : gonflement étendu d’un membre vacciné d ; gonflement du visage g.
b. La fréquence dans laquelle l’urticaire et l’angio-œdème ont été classés est « rare ».
c. Sur la période de suivi de la sécurité de l’essai clinique jusqu’au 14 novembre 2020, une paralysie faciale périphérique aiguë (paralysie de Bell) a été rapportée chez quatre participants dans le groupe vaccin à ARNm contre la covid 19. La paralysie faciale est apparue le jour 37 après la première dose (ce participant n’a pas reçu la dose 2) et les jours 3, 9 et 48 après la dose 2. Aucun cas de paralysie faciale périphérique aiguë (paralysie de Bell) n’a été rapporté dans le groupe placebo.
d. Effets indésirables identifiés après l’autorisation.
e. Fait référence au bras dans lequel le vaccin a été administré.
f. Une fréquence plus élevée de la fièvre a été observée après la seconde dose par comparaison avec la première dose.
g. Des cas de gonflement du visage chez les personnes vaccinées ayant reçu des injections de produits de comblement dermique ont été signalés lors de la phase post-commercialisation.
h. La rougeur au site d’injection est survenue plus fréquemment (très fréquente) chez les enfants âgés de 5 à 11 ans, et chez les participants immunodéprimés âgés de 5 ans et plus.
i. La fréquence dans laquelle le rash a été classé est « fréquent » chez les participants âgés de 6 à 23 mois.
j. La fréquence dans laquelle la diminution de l’appétit a été classée est « très fréquent » chez les participants âgés de 6 à 23 mois
k. L’irritabilité, la sensibilité au site d’injection et la somnolence concernent uniquement les participants âgés de 6 à 23 mois.
l. La plupart des cas se sont révélés de nature non grave et temporaire.
j. La catégorie de fréquence des vomissements était très fréquente chez les femmes enceintes âgées de 18 ans et plus, et chez les participants immunodéprimés âgés de 2 à 18 ans.
1.3. Populations particulières
Nourrissons nés de femmes ayant participé à une étude pendant leur grossesse – après 2 doses de Comirnaty
L’étude de phase II/III contrôlée contre placebo C4591015 (étude 9) a évalué 346 femmes enceintes ayant reçu Comirnaty (n = 173) ou un placebo (n = 173). Les nourrissons (n = 167 pour Comirnaty, n = 168 pour le placebo) ont été évalués sur une durée allant jusqu’à 6 mois. Aucun problème de sécurité attribuable à l’administration de Comirnaty chez la mère n’a été identifié.
Participants immunodéprimés (adultes et enfants)
Dans l’étude C4591024 (étude 10), 124 participants immunodéprimés âgés de 2 ans et plus ont reçu Comirnaty (voir rubrique "Pharmacodynamie").
1.4. Description de certains effets indésirables
Myocardite et péricardite
Le risque accru de myocardite après vaccination par Comirnaty est plus élevé chez les hommes plus jeunes (voir rubrique "Mises en garde et précautions d'emploi").
L’excès de risque chez les hommes plus jeunes après la seconde dose de Comirnaty a été évalué dans le cadre de deux grandes études pharmaco-épidémiologiques européennes. Une étude a montré qu’au cours d’une période de 7 jours suivant la seconde dose, on comptait environ 0,265 (IC à 95 % : 0,255 - 0,275) cas supplémentaire de myocardite chez les hommes âgés de 12 à 29 ans pour 10 000 personnes vaccinées par rapport à des personnes non exposées. Dans une autre étude, sur une période de 28 jours suivant la seconde dose, on comptait 0,56 (IC à 95 % : 0,37 - 0,74) cas supplémentaire de myocardite chez les hommes âgés de 16 à 24 ans pour 10 000 personnes vaccinées par rapport à des personnes
non exposées.
Des données limitées semblent indiquer que le risque de myocardite et de péricardite après vaccination par Comirnaty est plus faible chez les enfants âgés de 5 à 11 ans que chez les adolescents de 12 à 17 ans.
2. Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Comirnaty KP.2 n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines. Cependant, certains des effets indésirables mentionnés dans la rubrique "Effets indésirables" peuvent altérer temporairement l’aptitude à conduire des véhicules ou à utiliser des machines.
3. Surdosage
L’administration de doses de Comirnaty supérieures aux doses recommandées a été rapportée au cours des études cliniques et après la mise sur le marché. En général, les événements indésirables rapportés lors des surdosages correspondaient au profil connu des effets indésirables de Comirnaty.
En cas de surdosage, une surveillance des fonctions vitales et un traitement symptomatique éventuel sont recommandés.
4. Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration – voir Annexe V.
Un plan de gestion des risques a été défini par l'Agence européenne du médicament.
Les professionnels de santé et les usagers devront signaler les éventuels événements indésirables graves sur le portail des signalements du Gouvernement.
Pharmacodynamie
Classe pharmacothérapeutique : vaccins, vaccins viraux.
Code ATC : J07BN01.
1. Mécanisme d’action
L’ARN messager à nucléoside modifié contenu dans Comirnaty est formulé dans des nanoparticules lipidiques, permettant de délivrer l’ARN non réplicatif dans les cellules-hôtes et l’expression directe et transitoire de l’antigène S du SARS-CoV-2. L’ARNm code pour la protéine S de pleine longueur, à ancrage membranaire, avec deux mutations ponctuelles au sein de l’hélice centrale. La mutation de ces deux acides aminés en proline permet de stabiliser la protéine S dans sa conformation de préfusion pour une meilleure antigénicité.
Le vaccin induit à la fois la production d’anticorps neutralisants et une immunité cellulaire en réponse à l’antigène Spike (S), pouvant contribuer à la protection contre la covid 19.
2 Efficacité
Version de Comirnaty adaptée à Omicron
Immunogénicité chez les nourrissons et les enfants âgés de 6 mois à 4 ans – après une dose de rappel (quatrième dose)
Dans le cadre de l’analyse d’un sous-groupe de l’étude 6, 310 participants âgés de 6 mois à 4 ans ont reçu une dose de rappel (quatrième dose) de Comirnaty Original/Omicron BA.4-5 (1,5/1,5 microgrammes) après avoir reçu auparavant 3 doses de Comirnaty 3 microgrammes/dose dispersion à diluer pour dispersion injectable. Les résultats incluent les données d’immunogénicité issues d’un sous-groupe comparateur de participants âgés de 6 mois à 4 ans qui ont reçu 3 doses de Comirnaty 3 microgrammes/dose dispersion à diluer pour dispersion injectable au cours de l’étude 3.
Les analyses des NT50 dirigés contre Omicron BA.4-5 et contre la souche de référence, chez les participants âgés de 6 mois à 5 ans ayant reçu une dose de rappel de Comirnaty (BA.4-5 bivalent) au cours de l’étude 6, par comparaison avec un sous-groupe de participants de l’étude 3 ayant reçu 3 doses de Comirnaty, ont démontré la supériorité de la réponse contre Omicron BA.4-5 sur la base du RMG et sa non‑infériorité sur la base de la différence entre les taux de réponse sérologique, ainsi que la non-infériorité de la réponse immunitaire contre la souche de référence sur la base du RMG aussi bien que de la différence entre les taux de réponse sérologique (tableau 1).
Tableau 1 : Sous-étude B, groupe 2 – ratios des moyennes géométriques des titres et différence de pourcentages de participants présentant une réponse sérologique (1 mois après la dose 4 dans l’étude 6 / 1 mois après la dose 3 dans l’étude 3) – participants avec ou sans signe d’infection – âgés de 6 mois à 4 ans – population évaluable pour l’immunogénicité.
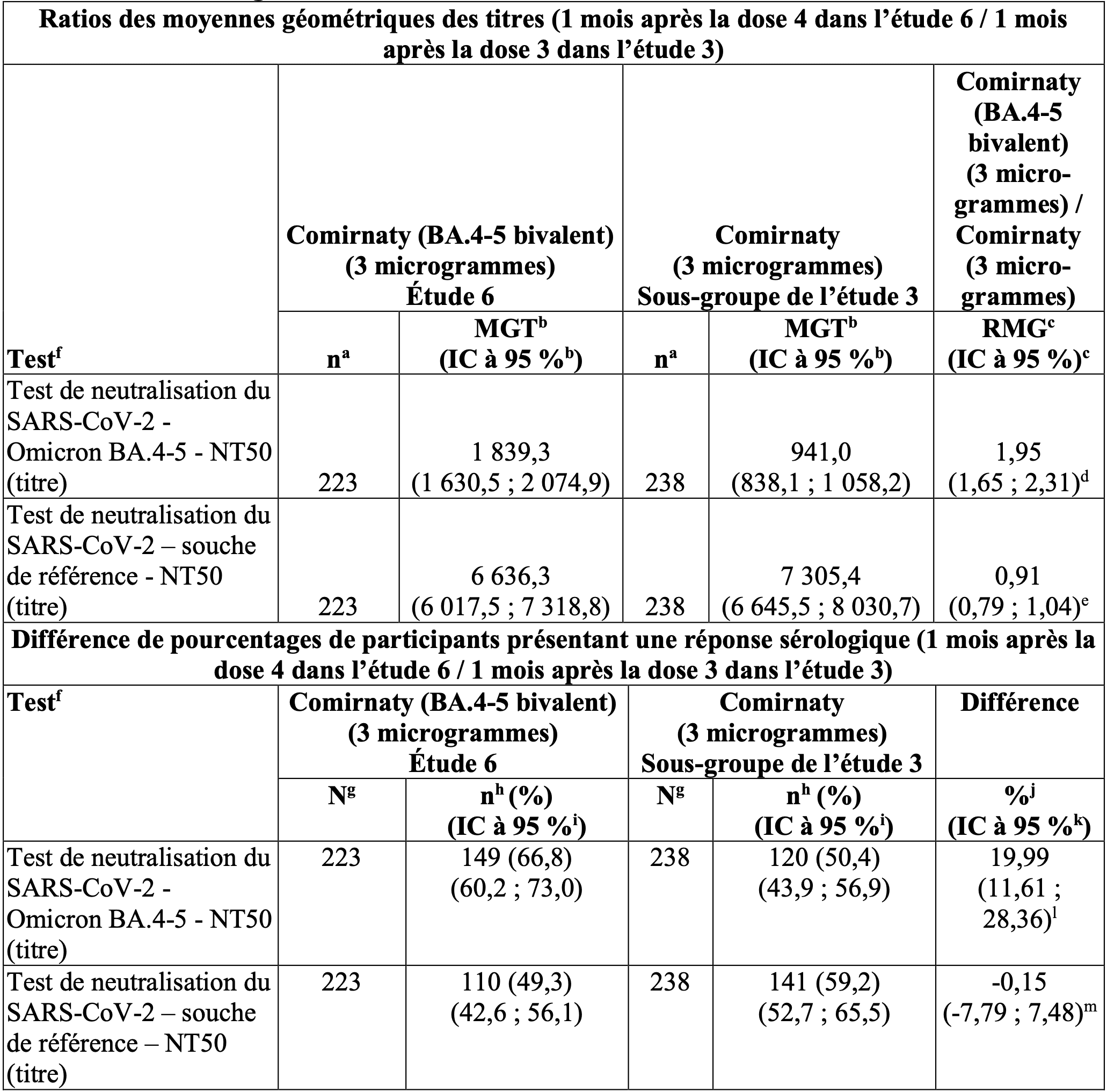
Remarque : La réponse sérologique est établie sur la base de l’obtention d’une augmentation d’un facteur ≥ 4 par rapport à l’inclusion (avant la première dose de vaccin administrée dans l’étude). Si la mesure à l’inclusion est inférieure à la LIQ, une mesure post-vaccination ≥ 4 × LIQ est considérée comme une réponse sérologique.
a. n = nombre de participants disposant de résultats de test valides et déterminants pour le test indiqué au moment prévu pour le prélèvement.
b. Les MGT et les IC bilatéraux ont été calculés en exponentialisant les MMC et les IC correspondants sur la base de l’analyse des résultats de test log-transformés à l’aide d’un modèle de régression linéaire, en utilisant comme covariables les titres neutralisants log-transformés à l’inclusion, le statut infectieux post-inclusion, le groupe d’âge (pour les participants de ≥ 6 mois à < 5 ans uniquement) et le groupe de vaccination. Les résultats de test inférieurs à la LIQ ont été fixés à 0,5 × LIQ.
c. Les RMG et les IC bilatéraux ont été calculés en exponentialisant les différences entre les MMC pour le test et les IC correspondants sur la base d’un modèle de régression similaire à celui indiqué ci-dessus.
d. La supériorité est déclarée si la limite inférieure de l’IC bilatéral à 95 % pour le RMG est supérieure à 1.
e. La non-infériorité est déclarée si la limite inférieure de l’IC bilatéral à 95 % pour le RMG est supérieure à 0,67 et si la valeur estimée du RMG est ≥ 0,8.
f. Les NT50 contre le SARS-CoV-2 ont été déterminés en utilisant une plateforme de test validée à 384 puits (souche originelle [USA-WA1/2020, isolée en janvier 2020] et Omicron B.1.1.529, sous-variant BA.4/BA.5).
g. N = nombre de participants disposant de résultats de test valides et déterminants pour le test indiqué avant la vaccination et au moment prévu pour le prélèvement. Ces valeurs sont les dénominateurs utilisés pour le calcul des pourcentages.
h. n = nombre de participants présentant une réponse sérologique lors du test indiqué au moment du prélèvement indiqué.
i. IC bilatéral exact basé sur la méthode de Clopper-Pearson.
j. Différence ajustée entre les proportions, basée sur la méthode de Miettinen et Nurminen, stratifiée par niveau de titre d’anticorps neutralisants initial (< médiane ou ≥ médiane), exprimée en pourcentage, entre Comirnaty (BA.4‑5 bivalent) [3 microgrammes] et Comirnaty [3 microgrammes]. La valeur médiane des titres d’anticorps neutralisants initiaux a été calculée sur la base des données groupées issues des 2 groupes comparateurs.
k. IC bilatéral, basé sur la méthode de Miettinen et Nurminen pour la différence entre les proportions, stratifié par niveau de titre d’anticorps neutralisants initial (< médiane ou ≥ médiane), exprimé en pourcentage.
l. La non-infériorité est déclarée si la limite inférieure de l’IC bilatéral à 95 % pour la différence de pourcentages de participants présentant une réponse sérologique est > -5 %.
m. La non-infériorité est déclarée si la limite inférieure de l’IC bilatéral à 95 % pour la différence de pourcentages de participants présentant une réponse sérologique est > -10 %.
Immunogénicité chez les enfants âgés de 5 à 11 ans (c.-à-d. de 5 à moins de 12 ans) – après une dose de rappel (quatrième dose)
Dans le cadre de l’analyse d’un sous-groupe de l’étude 6, 103 participants âgés de 5 à 11 ans qui avaient déjà reçu les 2 doses du schéma de primo-vaccination et une dose de rappel de Comirnaty ont reçu une dose de rappel (quatrième dose) de Comirnaty Original/Omicron BA.4-5. Les résultats incluent les données d’immunogénicité issues d’un sous-groupe comparateur de participants âgés de 5 à 11 ans qui ont reçu 3 doses de Comirnaty au cours de l’étude 3. Parmi les participants âgés de 5 à 11 ans ayant reçu une quatrième dose de Comirnaty Original/Omicron BA.4-5 et les participants âgés de 5 à 11 ans ayant reçu une troisième dose de Comirnaty, 57,3 % et 58,4 % étaient séropositifs au SARS-CoV-2 à l’inclusion, respectivement.
La réponse immunitaire, 1 mois après la dose de rappel (quatrième dose) de Comirnaty Original/Omicron BA.4-5, a généralement engendré des titres d’anticorps neutralisants spécifiques à Omicron BA.4/BA.5 similaires aux titres observés dans le groupe comparateur ayant reçu 3 doses de Comirnaty. Comirnaty Original/Omicron BA.4-5 a également engendré des titres d’anticorps neutralisants spécifiques à la souche de référence similaires aux titres observés dans le groupe comparateur.
Les résultats relatifs à l’immunogénicité du vaccin après la dose de rappel chez les participants âgés de 5 à 11 ans sont présentés dans le tableau 2.
Tableau 2 : Étude 6 – ratio des moyennes géométriques des titres et moyenne géométrique des titres – participants avec ou sans signe d’infection – âgés de 5 à 11 ans – population évaluable pour l’immunogénicité.
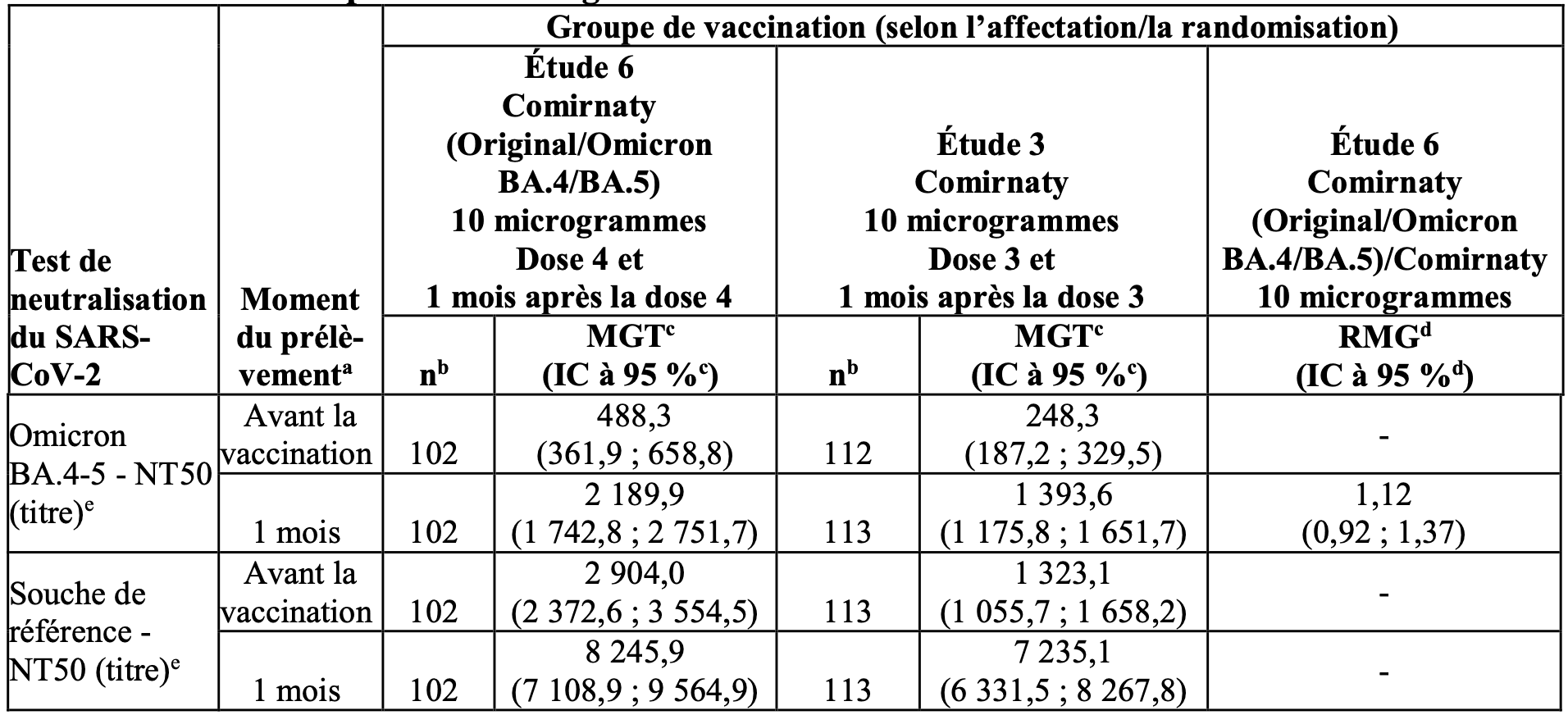
a. Moment défini par le protocole pour le prélèvement de l’échantillon sanguin.
b. n = nombre de participants disposant de résultats de test valides et déterminants pour le test indiqué au moment prévu pour le prélèvement.
c. Les MGT et les IC bilatéraux à 95 % ont été calculés en exponentialisant le logarithme moyen des titres et les IC correspondants (sur la base de la distribution t de Student). Les résultats de test inférieurs à la LIQ ont été fixés à 0,5 × LIQ.
d. Les RMG et les IC bilatéraux à 95 % ont été calculés en exponentialisant les différences entre les moyennes des MC pour le test et les IC correspondants sur la base de l’analyse des résultats de test log-transformés en utilisant un modèle de régression linéaire avec les titres d’anticorps neutralisants initiaux log-transformés, le statut infectieux post-inclusion et le groupe de vaccination comme covariables.
e. Les NT50 contre le SARS-CoV-2 ont été déterminés en utilisant une plateforme de test validée à 384 puits (souche originelle [USA-WA1/2020, isolée en janvier 2020] et Omicron B.1.1.529, sous-variant BA.4/BA.5).
Immunogénicité chez les participants âgés de 12 ans et plus – après une dose de rappel (quatrième dose)
Dans le cadre de l’analyse d’un sous-groupe de l’étude 5, 105 participants âgés de 12 à 17 ans, 297 participants âgés de 18 à 55 ans et 286 participants âgés de 56 ans et plus qui avaient déjà reçu les 2 doses du schéma de primo-vaccination et une dose de rappel de Comirnaty ont reçu une dose de rappel (quatrième dose) de Comirnaty Original/Omicron BA.4-5. Parmi les participants âgés de 12 à 17 ans, de 18 à 55 ans et de 56 ans et plus, 75,2 %, 71,7 % et 61,5 % étaient séropositifs au SARS-CoV-2 à l’inclusion, respectivement.
Les analyses des titres d’anticorps neutralisants à 50 % (NT50) dirigés contre Omicron BA.4-5 et contre la souche de référence, chez les participants âgés de 56 ans et plus ayant reçu une dose de rappel (quatrième dose) de Comirnaty Original/Omicron BA.4-5 au cours de l’étude 5, par comparaison avec un sous-groupe de participants de l’étude 4 ayant reçu une dose de rappel (quatrième dose) de Comirnaty, ont démontré la supériorité de Comirnaty Original/Omicron BA.4-5 par rapport à Comirnaty sur la base du ratio des moyennes géométriques des titres (RMG) et sa non‑infériorité sur la base des taux de réponse sérologique, s’agissant de la réponse contre Omicron BA.4-5, ainsi que la non-infériorité de la réponse immunitaire contre la souche de référence sur la base du RMG (tableau 3).
Les analyses des NT50 dirigés contre Omicron BA.4/BA.5, chez les participants âgés de 18 à 55 ans par comparaison avec les participants âgés de 56 ans et plus ayant reçu une dose de rappel (quatrième dose) de Comirnaty Original/Omicron BA.4-5 au cours de l’étude 5, ont démontré la non-infériorité de la réponse contre Omicron BA.4-5 chez les participants âgés de 18 à 55 ans par rapport aux participants âgés de 56 ans et plus, sur la base du RMG aussi bien que de la différence entre les taux de réponse sérologique (tableau 3).
L’étude a également évalué le niveau de NT50 dirigés contre le variant Omicron BA.4-5 du SARS‑CoV‑2 et contre les souches de référence avant la vaccination et 1 mois après la vaccination des participants ayant reçu une dose de rappel (quatrième dose) (tableau 4).
Tableau 3 : MGT du SARS-CoV-2 (NT50) et différence de pourcentages de participants présentant une réponse sérologique 1 mois après la vaccination – Comirnaty Original/Omicron BA.4-5 dans l’étude 5 et Comirnaty dans le sous-groupe de l’étude 4 – participants avec ou sans signe d’infection par le SARS-CoV-2 – population évaluable pour l’immunogénicité.
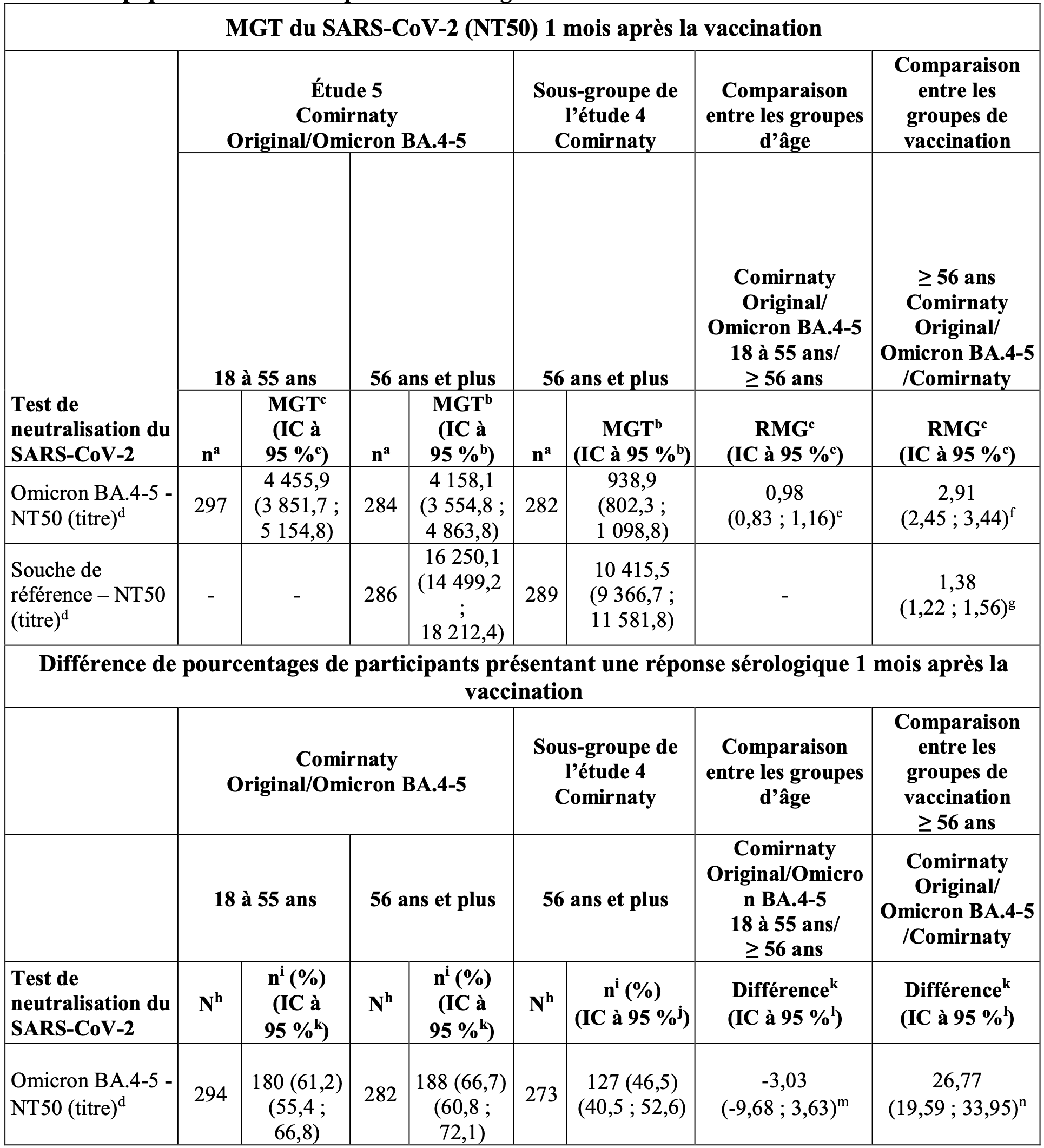
Remarque : La réponse sérologique est établie sur la base de l’obtention d’une augmentation d’un facteur ≥ 4 par rapport à l’inclusion. Si la mesure à l’inclusion est inférieure à la LIQ, une mesure post-vaccination ≥ 4 × LIQ est considérée comme une réponse sérologique.
a. n = nombre de participants disposant de résultats de test valides et déterminants pour le test indiqué au moment prévu pour le prélèvement.
b. Les MGT et les IC bilatéraux à 95 % ont été calculés en exponentialisant le logarithme moyen des titres et les IC correspondants (sur la base de la distribution t de Student). Les résultats de test inférieurs à la LIQ ont été fixés à 0,5 × LIQ.
c. Les RMG et les IC bilatéraux à 95 % ont été calculés en exponentialisant les différences entre les moyennes des MC et les IC correspondants sur la base de l’analyse des titres d’anticorps neutralisants log-transformés en utilisant un modèle de régression linéaire avec pour variables le titre d’anticorps neutralisants initial (échelle logarithmique) et le groupe de vaccination ou le groupe d’âge.
d. Les NT50 contre le SARS-CoV-2 ont été déterminés en utilisant une plateforme de test validée à 384 puits (souche originelle [USA-WA1/2020, isolée en janvier 2020] et Omicron B.1.1.529, sous-variant BA.4/BA.5).
e. La non-infériorité est déclarée si la limite inférieure de l’IC bilatéral à 95 % pour le RMG est supérieure à 0,67.
f. La supériorité est déclarée si la limite inférieure de l’IC bilatéral à 95 % pour le RMG est supérieure à 1.
g. La non-infériorité est déclarée si la limite inférieure de l’IC bilatéral à 95 % pour le RMG est supérieure à 0,67 et si la valeur estimée du RMG est ≥ 0,8.
h. N = nombre de participants disposant de résultats de test valides et déterminants pour le test indiqué avant la vaccination et au moment prévu pour le prélèvement. Cette valeur est le dénominateur utilisé pour le calcul des pourcentages.
i. n = nombre de participants présentant une réponse sérologique lors du test indiqué au moment du prélèvement indiqué.
j. IC bilatéral exact basé sur la méthode de Clopper-Pearson.
k. Différence entre les proportions, exprimée en pourcentage.
l. IC bilatéral basé sur la méthode de Miettinen et Nurminen, stratifié par niveau de titre d’anticorps neutralisants initial (< médiane ou ≥ médiane), pour la différence entre les proportions. La valeur médiane des titres d’anticorps neutralisants initiaux a été calculée sur la base des données groupées issues des 2 groupes comparateurs.
m. La non-infériorité est déclarée si la limite inférieure de l’IC bilatéral à 95 % pour la différence de pourcentages de participants présentant une réponse sérologique est > -10 %.
n. La non-infériorité est déclarée si la limite inférieure de l’IC bilatéral à 95 % pour la différence de pourcentages de participants présentant une réponse sérologique est > -5 %.
Tableau 4 : Moyenne géométrique des titres – Comirnaty Original/Omicron BA.4-5, sous‑groupes de l’étude 5 – avant et 1 mois après la dose de rappel (quatrième dose) – participants âgés de 12 ans et plus – avec ou sans signe d’infection – population évaluable pour l’immunogénicité.
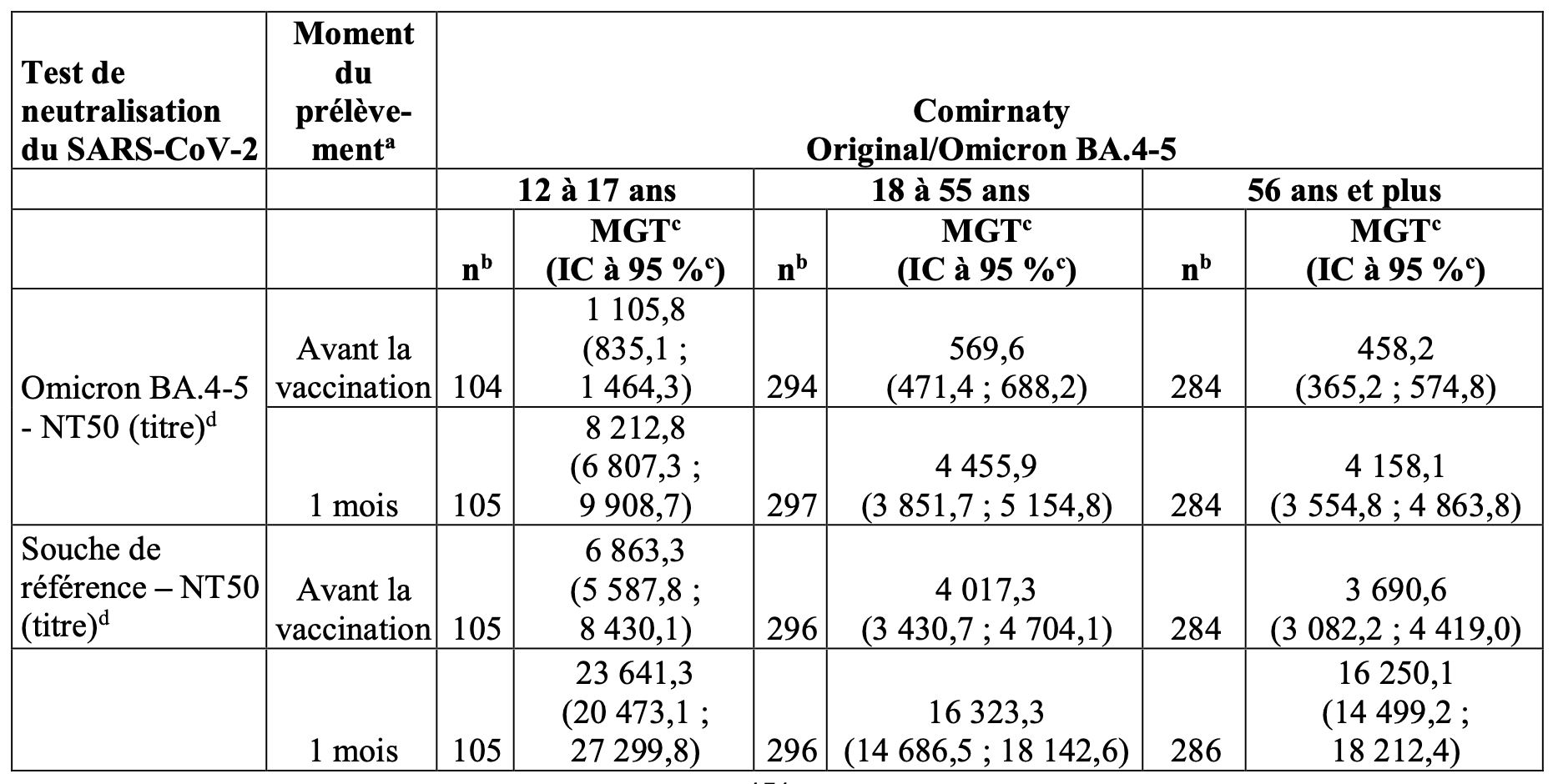
a. Moment défini par le protocole pour le prélèvement de l’échantillon sanguin.
b. n = nombre de participants disposant de résultats de test valides et déterminants pour le test indiqué au moment prévu pour le prélèvement.
c. Les MGT et les IC bilatéraux à 95 % ont été calculés en exponentialisant le logarithme moyen des titres et les IC correspondants (sur la base de la distribution t de Student). Les résultats de test inférieurs à la LIQ ont été fixés à 0,5 × LIQ.
d. Les NT50 contre le SARS-CoV-2 ont été déterminés en utilisant une plateforme de test validée à 384 puits (souche originelle [USA-WA1/2020, isolée en janvier 2020] et Omicron B.1.1.529, sous-variant BA.4‑5).
Vaccin Comirnaty initialement approuvé
L’étude 2 est une étude d’efficacité, de sélection du candidat vaccin et de recherche de dose avec observateur en aveugle, multicentrique, internationale, de phase 1/2/3, randomisée, contrôlée contre placebo, menée chez des participants âgés de 12 ans et plus. La randomisation a été stratifiée par groupe d’âge : 12 à 15 ans, 16 à 55 ans ou 56 ans et plus, avec un minimum de 40 % de participants dans le groupe des ≥ 56 ans. Les sujets qui étaient immunodéprimés et ceux pour lesquels un diagnostic clinique ou microbiologique de covid 19 avait été précédemment établi ont été exclus de l’étude. Les participants présentant une affection préexistante stable, c’est-à-dire ne nécessitant pas de modification significative du traitement ou une hospitalisation pour cause d’aggravation de la maladie dans les 6 semaines précédant le recrutement, ont été inclus, de même que les participants présentant une infection connue et stable par le virus de l’immunodéficience humaine (VIH), le virus de l’hépatite C (VHC) ou le virus de l’hépatite B (VHB).
Efficacité chez les participants âgés de 16 ans et plus - après 2 doses
Dans la partie de phase 2/3 de l’étude 2, basée sur les données collectées jusqu’au 14 novembre 2020, environ 44 000 participants ont été randomisés de façon égale, afin de recevoir 2 doses du vaccin à ARNm initialement approuvé contre la covid 19 ou de placebo. Les analyses de l’efficacité ont inclus les participants ayant reçu leur seconde dose dans les 19 à 42 jours suivant la première dose. La majorité des participants vaccinés (93,1 %) ont reçu la seconde dose 19 à 23 jours après la première dose. Le suivi des participants est prévu sur une durée allant jusqu’à 24 mois après la dose 2, afin d’évaluer la sécurité et l’efficacité du vaccin contre la covid 19. Dans l’étude clinique, pour l’administration d’un vaccin contre la grippe, il a été demandé aux participants de respecter un intervalle de 14 jours minimum avant ou après l’administration du placebo ou du vaccin à ARNm contre la covid 19. Dans l’étude clinique, les participants ne devaient pas recevoir de produits sanguins/plasmatiques ou d’immunoglobulines dans un intervalle minimum de 60 jours avant ou après l’administration du placebo ou du vaccin à ARNm contre la covid 19 et ce jusqu’à la fin de l’étude.
La population pour l’analyse du critère d’évaluation primaire de l’efficacité comprenait 36 621 participants âgés de 12 ans et plus (18 242 dans le groupe vaccin à ARNm contre la covid 19 et 18 379 dans le groupe placebo) sans infection antérieure par le SARS-CoV-2 jusqu’à 7 jours après la seconde dose. Par ailleurs, 134 participants étaient âgés de 16 ou 17 ans (66 dans le groupe vaccin à ARNm contre la covid 19 et 68 dans le groupe placebo) et 1 616 participants étaient âgés de 75 ans et plus (804 dans le groupe vaccin à ARNm contre la covid 19 et 812 dans le groupe placebo).
Au moment de l’analyse du critère primaire d’efficacité, les participants ont été suivis afin de surveiller l’apparition d’une covid 19 symptomatique sur une durée totale de 2 214 personne-années pour le groupe vaccin à ARNm contre la covid 19 et de 2 222 personne-années pour le groupe placebo.
Aucune différence clinique significative n’a été observée pour l’efficacité globale du vaccin chez les participants à risque d’évolution sévère de la covid 19, notamment ceux présentant 1 ou plusieurs comorbidités augmentant le risque de covid 19 sévère (par exemple, asthme, indice de masse corporelle [IMC] ≥ 30 kg/m2, pneumopathie chronique, diabète, hypertension).
Les informations sur l’efficacité du vaccin sont présentées dans le tableau 5.
Tableau 5 : Efficacité du vaccin – premier épisode de la covid 19 à partir de 7 jours après la dose 2, par sous-groupe d’âge – participants sans infection antérieure avant le délai de 7 jours après la dose 2 – population évaluable pour l’efficacité (7 jours).
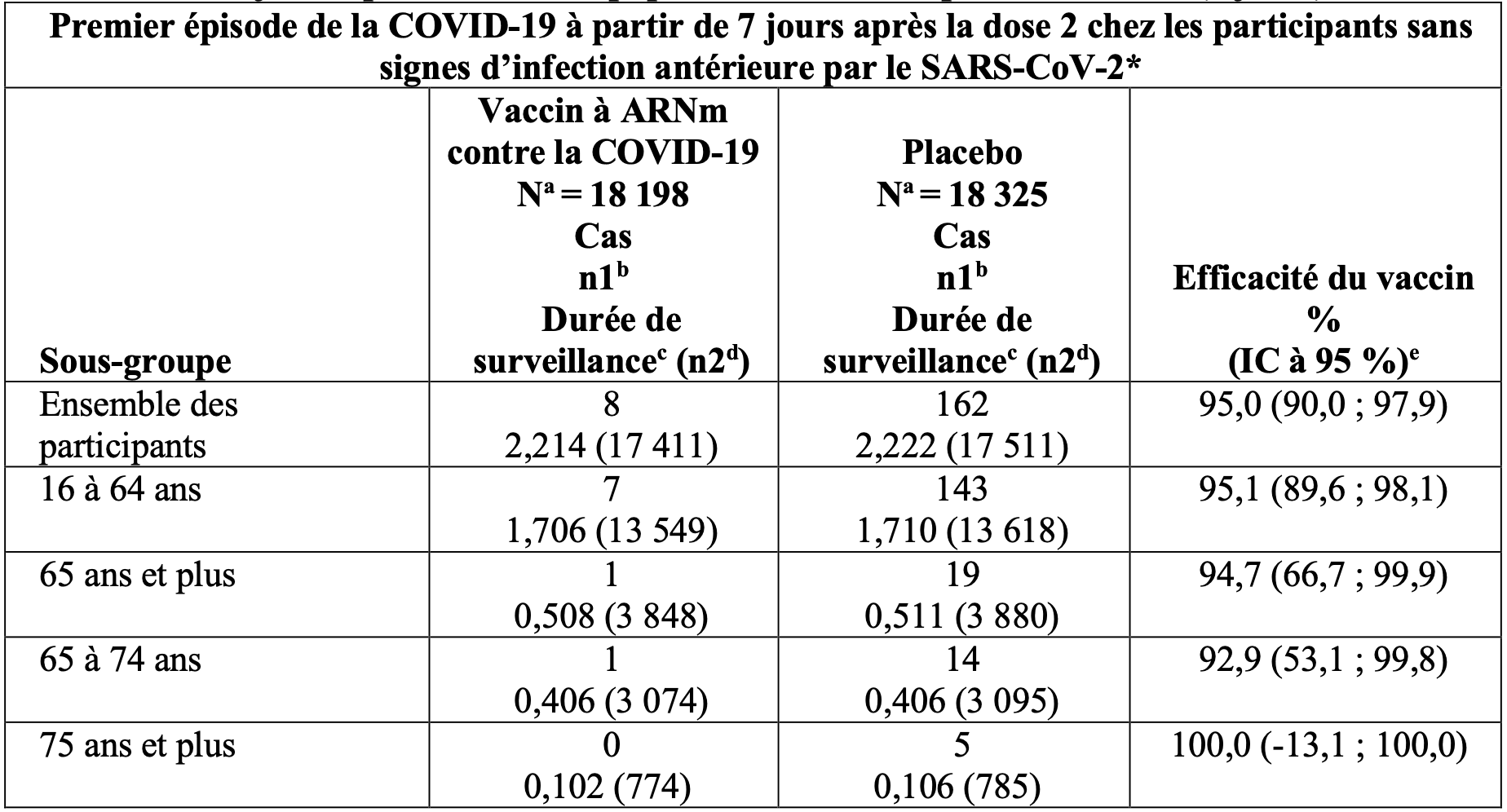
* Les participants ne présentant aucun critère sérologique ou virologique (avant le délai de 7 jours après avoir reçu la dernière dose) d’une infection antérieure par le SARS-CoV-2 (c.-à-d. absence d’anticorps [sérique] fixant la protéine N lors de la visite 1 et sans détection de SARS-CoV-2 par le test d’amplification des acides nucléiques (TAAN) [prélèvement nasal] lors des visites 1 et 2) et ayant eu un résultat négatif au test TAAN (prélèvement nasal) lors de toute visite non programmée avant le délai de 7 jours après la dose 2 ont été inclus dans l’analyse.
a. N = nombre de participants dans le groupe indiqué.
b. n1 = nombre de participants répondant à la définition du critère d’évaluation.
c. Durée de surveillance totale en 1 000 personne-années pour le critère d’évaluation indiqué sur l’ensemble des participants au sein de chaque groupe à risque pour le critère d’évaluation. La période de temps pour le cumul des cas de covid 19 s’étend de 7 jours après la dose 2 jusqu’à la fin de la période de surveillance.
d. n2 = nombre de participants à risque pour le critère d’évaluation.
e. L’intervalle de confiance (IC) bilatéral pour l’efficacité du vaccin est issu de la méthode de Clopper-Pearson avec ajustement en fonction de la durée de surveillance. IC non ajusté pour tenir compte de la multiplicité.
L’efficacité du vaccin à ARNm contre la covid 19 pour prévenir le premier épisode de la covid 19 à partir de 7 jours après la dose 2, comparativement au placebo, a été de 94,6 % (intervalle de confiance à 95 % de 89,6 % à 97,6 %) chez les participants âgés de 16 ans et plus avec ou sans infection antérieure par le SARS-CoV-2.
Par ailleurs, les analyses par sous-groupes du critère primaire d’efficacité ont montré des valeurs estimées d’efficacité similaires de l’efficacité en fonction du sexe, du groupe ethnique, ainsi que chez les participants présentant des comorbidités associées à un risque élevé de covid 19 sévère.
Des analyses actualisées de l’efficacité ont été réalisées avec des cas confirmés de covid 19 supplémentaires qui se sont ajoutés pendant le suivi en aveugle contrôlé par placebo, ce qui représente jusqu’à 6 mois après la dose 2 dans la population de l’étude.
Les informations actualisées sur l’efficacité vaccinale sont présentées au Tableau 6.
Tableau 6 : Efficacité du vaccin – premier épisode de la covid 19 à partir de 7 jours après la dose 2, par sous-groupe d’âge – participants sans signe d’infection antérieure par le SARS-CoV-2* avant le délai de 7 jours après la dose 2 – population évaluable pour l’efficacité (7 jours) pendant la période de suivi contrôlée par placebo.
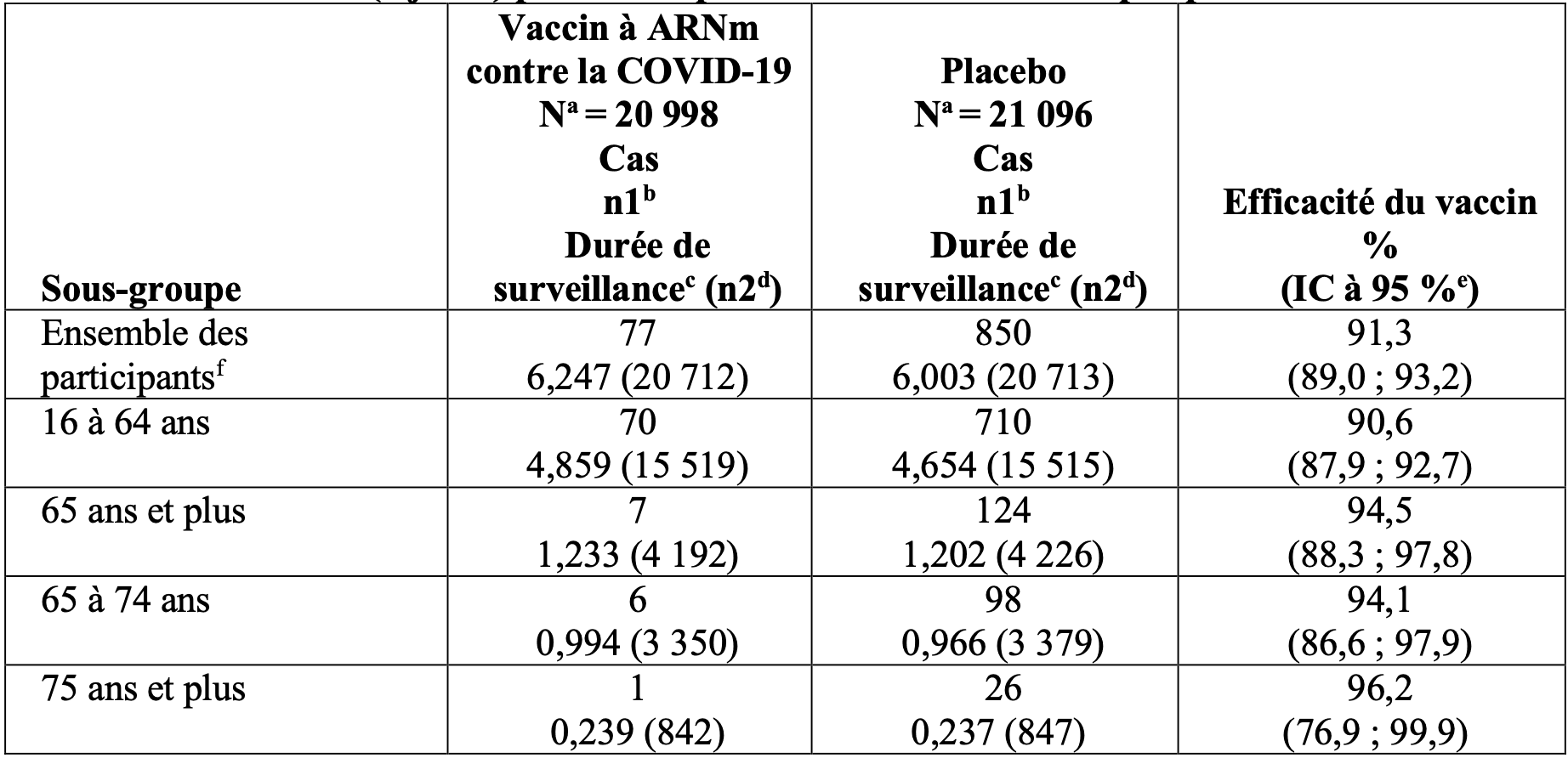
* Les participants ne présentant aucun critère d’une infection antérieure par le SARS-CoV-2 (c.-à-d. absence d’anticorps [sérique] fixant la protéine N lors de la visite 1 et sans détection de SARS-CoV-2 par le test TAAN [prélèvement nasal] lors des visites 1 et 2) et ayant eu un résultat négatif au test TAAN (prélèvement nasal) lors de toute visite non programmée avant le délai de 7 jours après la dose 2 ont été inclus dans
l’analyse.
a. N = nombre de participants dans le groupe indiqué.
b. n1 = nombre de participants répondant à la définition du critère d’évaluation.
c. Durée de surveillance totale en 1 000 personne-années pour le critère d’évaluation indiqué sur l’ensemble des
participants au sein de chaque groupe à risque pour le critère d’évaluation. La période de temps pour le cumul
des cas de covid 19 s’étend de 7 jours après la dose 2 jusqu’à la fin de la période de surveillance.
d. n2 = nombre de participants à risque pour le critère d’évaluation.
e. L’intervalle de confiance (IC) bilatéral à 95 % pour l’efficacité du vaccin est issu de la méthode de Clopper-Pearson avec ajustement en fonction de la durée de surveillance.
f. Comprenant des cas confirmés de participants âgés de 12 à 15 ans : 0 dans le groupe vaccin à ARNm contre la covid 19 ; 16 dans le groupe placebo.
Dans l’analyse actualisée de l’efficacité, l’efficacité du vaccin à ARNm contre la covid 19 pour prévenir le premier épisode de la covid 19 à partir de 7 jours après la dose 2, comparativement au placebo, a été de 91,1 % (intervalle de confiance à 95 % de 88,8 % à 93,0 %) durant la période où la souche originelle de Wuhan et le variant Alpha étaient les principales souches en circulation chez les participants faisant partie de la population d’efficacité évaluable avec ou sans signe d’infection antérieure par le SARS-CoV-2.
Par ailleurs, les analyses par sous-groupes de l’efficacité ont montré des valeurs estimées d’efficacité similaires en fonction du sexe, du groupe ethnique, de la géographie ainsi que chez les participants présentant des comorbidités et une obésité associées à un risque élevé de covid 19 sévère.
Efficacité contre la covid 19 sévère
Des analyses actualisées des critères d’évaluation secondaires d’efficacité ont étayé le bénéfice du vaccin à ARNm contre la covid 19 dans la prévention de la covid 19.
Au 13 mars 2021, l’efficacité du vaccin contre la covid 19 sévère est présentée uniquement pour les participants avec ou sans infection antérieure par le SARS-CoV-2 (Tableau 7), car le nombre de cas de covid 19 chez les participants sans infection antérieure par le SARS-CoV-2 était le même que celui des participants avec ou sans infection antérieure par le SARS-CoV-2 dans le groupe ayant reçu le vaccin à ARNm contre la covid 19 et dans le groupe ayant reçu le placebo.
Tableau 7 : Efficacité du vaccin – premier épisode de la covid 19 sévère chez des participants avec ou sans infection antérieure selon la FDA (Food and Drug Administration)* après la dose 1 ou à partir de 7 jours après la dose 2 pendant le suivi contrôlé par placebo.
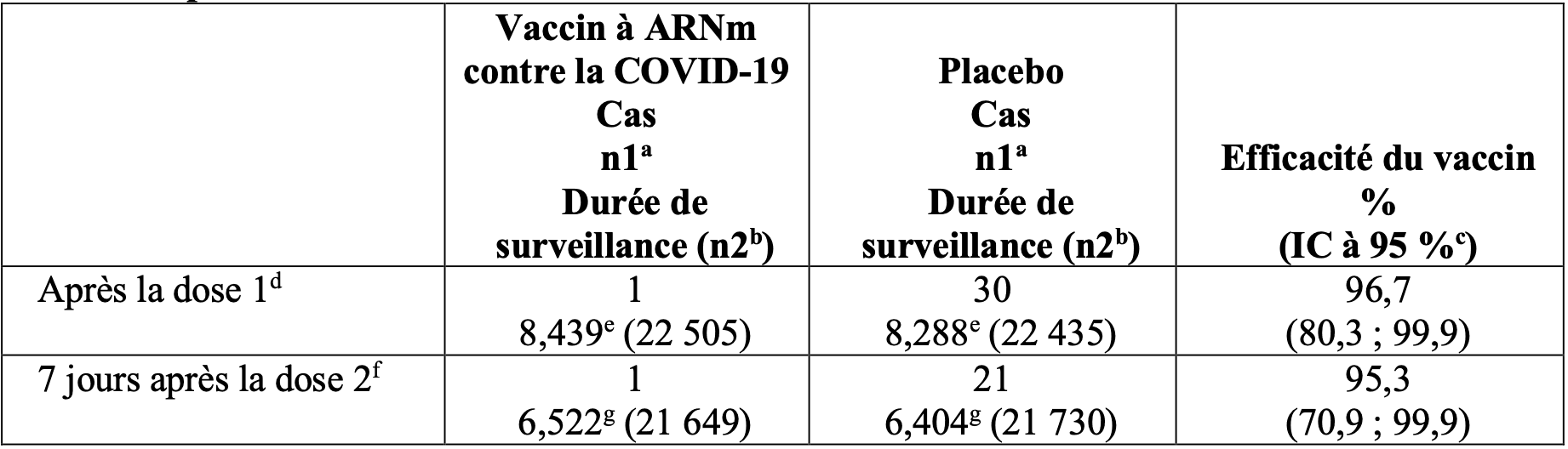
* la covid 19 sévère, comme définie par la FDA, est une covid 19 confirmée et la présence d’au moins un
des symptômes suivants :
• Signes cliniques au repos indiquant une maladie systémique sévère (rythme respiratoire ≥ 30 respirations par minute, rythme cardiaque ≥ 125 battements par minute, saturation en oxygène ≤ 93 % dans l’air ambient de la pièce au niveau de la mer, ou rapport de la pression partielle de l’oxygène artérielle sur la fraction d’oxygène inspiré < 300 mm HG) ;
• Insuffisance respiratoire (définie comme étant la nécessité d’oxygène à haut débit, d’une ventilation non invasive, d’une ventilation mécanique ou d’une oxygénation extracorporelle [ECMO]) ;
• Signe d’un choc (pression artérielle systolique < 90 mm Hg, pression artérielle diastolique < 60 mm Hg ou nécessité de recourir à des vasopresseurs ;
• Dysfonctionnement rénal, hépatique ou neurologique aigu significatif ;
• Admission en unité de soins intensifs ;
• Décès.
a. n1 = nombre de participants répondant à la définition du critère d’évaluation.
b. n2 = nombre de participants à risque de présenter le critère d’évaluation.
c. L’intervalle de confiance (IC) bilatéral pour l’efficacité du vaccin est issu de la méthode de Clopper-Pearson avec ajustement en fonction de la durée de surveillance.
d. Efficacité évaluée sur base de l’ensemble de la population d’efficacité disponible (intention de traiter modifiée) ayant reçu la dose 1 comprenant tous les participants randomisés qui avaient reçu au moins 1 dose de vaccin à l’étude.
e. Durée de surveillance totale en 1 000 personne-années pour le critère d’évaluation indiqué sur l’ensemble des participants au sein de chaque groupe à risque pour le critère d’évaluation. La période de temps pour le cumul des cas de covid 19 s’étend de la dose 1 jusqu’à la fin de la période de surveillance.
f. Efficacité évaluée sur base de la population évaluable pour l’efficacité (7 jours) qui incluait l’ensemble des participants randomisés éligibles ayant reçu toutes les doses du vaccin à l’étude, tels que randomisés dans la fenêtre prédéfinie, et n’ayant pas eu d’autres déviations importantes au protocole selon l’avis du médecin.
g. Durée de surveillance totale en 1 000 personne-années pour le critère d’évaluation indiqué sur l’ensemble des participants au sein de chaque groupe à risque pour le critère d’évaluation. La période de temps pour le cumul des cas de covid 19 s’étend de 7 jours après la dose 2 jusqu’à la fin de la période de surveillance.
Efficacité et immunogénicité chez les adolescents de 12 à 15 ans – après 2 doses
Lors d’une analyse initiale de l’étude 2 portant sur des adolescents âgés de 12 à 15 ans (avec une durée médiane de suivi de > 2 mois après la dose 2) sans infection antérieure par le SARS-CoV-2, aucun cas de covid 19 n’a été rapporté parmi les 1 005 participants ayant reçu le vaccin alors que 16 cas ont été rapportés parmi les 978 ayant reçu le placebo. L’efficacité vaccinale estimée était de 100 % (intervalle de confiance à 95 % de 75,3 à 100,0). Parmi les participants avec ou sans infection antérieure par le SARS-CoV-2, aucun cas n’a été rapporté chez les 1 119 participants vaccinés, tandis que 18 cas ont été rapportés chez 1 110 participants ayant reçu le placebo. Ces données indiquent également une efficacité estimée à 100 % (intervalle de confiance à 95 % de 78,1 à 100,0).
Des analyses actualisées de l’efficacité ont été réalisées avec les cas supplémentaires de covid 19 confirmés accumulés pendant la phase de suivi en aveugle, contrôlée contre placebo, représentant une période allant jusqu’à 6 mois après la dose 2 dans la population d’évaluation de l’efficacité.
D’après l’analyse actualisée de l’efficacité dans l’étude 2 chez les adolescents âgés de 12 à 15 ans sans infection antérieure, aucun cas de covid 19 n’a été rapporté parmi les 1 057 participants ayant reçu le vaccin alors que 28 cas ont été rapportés parmi les 1 030 participants ayant reçu le placebo. L’efficacité vaccinale estimée était de 100 % (intervalle de confiance à 95 % de 86,8 à 100,0) durant la période où le variant Alpha était la principale souche en circulation. Parmi les participants avec ou sans infection antérieure par le SARS-CoV-2, aucun cas n’a été rapporté chez les 1 119 participants vaccinés, tandis que 30 cas ont été rapportés chez les 1 109 participants ayant reçu le placebo. Ces données indiquent également une efficacité estimée à 100 % (intervalle de confiance à 95 % de 87,5 à 100,0).
Dans l’étude 2, une analyse des titres d’anticorps neutralisants contre le SARS-CoV-2 a été réalisée 1 mois après la dose 2 dans un sous-groupe de participants randomisés qui n’avaient aucune preuve sérologique ou virologique d’une infection antérieure par le SARS-CoV-2 jusqu’à 1 mois après la dose 2. Les réponses en anticorps neutralisants entre les adolescents âgés de 12 à 15 ans (n = 190) et les participants âgés de 16 à 25 ans (n = 170) ont été comparées.
Le ratio des moyennes géométriques des titres (MGT) en anticorps entre le groupe d’âge des 12 à 15 ans et le groupe d’âge des 16 à 25 ans était de 1,76, avec un IC bilatéral à 95 % de 1,47 à 2,10. Par conséquent, le critère de non-infériorité correspondant à un ratio fixé à 1,5, a été atteint puisque la limite inférieure de l’IC bilatéral à 95 % pour le ratio des moyennes géométriques (RMG) était > 0,67.
Efficacité et immunogénicité chez les enfants âgés de 5 à 11 ans (c.-à-d. de 5 à moins de 12 ans) – après 2 doses
L’étude 3 est une étude de phase 1/2/3 comprenant une phase de recherche de dose vaccinale en ouvert (phase 1) et une phase d’évaluation de l’efficacité, multicentrique, internationale, randomisée, contrôlée contre placebo (solution saline), avec observateur en aveugle (phase 2/3), dans laquelle des participants âgés de 5 à 11 ans ont été inclus. La majorité (94,4 %) des sujets randomisés ont reçu la deuxième dose 19 jours à 23 jours après la première dose.
Les résultats descriptifs initiaux concernant l’efficacité du vaccin chez les enfants âgés de 5 à 11 ans sans signes d’infection antérieure par le SARS-CoV-2 sont présentés dans le tableau 8. Aucun cas de covid 19 n’a été observé dans le groupe ayant reçu le vaccin ou dans le groupe ayant reçu le placebo parmi les participants présentant des signes d’infection antérieure par le SARS-CoV-2.
Tableau 8 : Efficacité du vaccin – premier épisode de la covid 19 à partir de 7 jours après la dose 2 : participants sans infection antérieure avant le délai de 7 jours après la dose 2 – phase 2/3 – population des enfants de 5 à 11 ans évaluables pour l’efficacité.

* Les participants ne présentant aucun critère d’une infection antérieure par le SARS-CoV-2 (c.-à-d. absence d’anticorps [sérique] fixant la protéine N lors de la visite 1 et sans détection de SARS-CoV-2 par le test TAAN [prélèvement nasal] lors des visites 1 et 2) et ayant eu un résultat négatif au test TAAN (prélèvement nasal) lors de toute visite non programmée avant le délai de 7 jours après la dose 2 ont été inclus dans
l’analyse.
a. N = nombre de participants dans le groupe indiqué.
b. n1 = nombre de participants répondant à la définition du critère d’évaluation.
c. Durée de surveillance totale en 1 000 personne-années pour le critère d’évaluation indiqué sur l’ensemble des participants au sein de chaque groupe à risque pour le critère d’évaluation. La période de temps pour le cumul des cas de covid 19 s’étend de 7 jours après la dose 2 jusqu’à la fin de la période de surveillance.
d. n2 = nombre de participants à risque pour le critère d’évaluation.
Une analyse de l’efficacité basée sur l’hypothèse prédéfinie a été réalisée avec les cas supplémentaires de covid 19 confirmés accumulés pendant la phase de suivi en aveugle, contrôlée contre placebo, représentant une période allant jusqu’à 6 mois après la dose 2 dans la population d’évaluation de
l’efficacité.
D’après l’analyse de l’efficacité dans l’étude 3 chez les enfants âgés de 5 à 11 ans sans infection antérieure, 10 cas de covid 19 ont été rapportés parmi les 2 703 participants ayant reçu le vaccin et 42 cas ont été rapportés parmi les 1 348 participants ayant reçu le placebo. L’efficacité vaccinale estimée était de 88,2 % (intervalle de confiance à 95 % de 76,2 à 94,7) durant la période où le variant Delta était la principale souche en circulation. Parmi les participants avec ou sans infection antérieure par le SARS-CoV-2, 12 cas ont été rapportés chez les 3 018 participants vaccinés et 42 cas ont été rapportés chez les 1 511 participants ayant reçu le placebo. L’efficacité vaccinale estimée était de 85,7 % (intervalle de confiance à 95 % de 72,4 à 93,2).
Dans l’étude 3, une analyse des titres d’anticorps neutralisants à 50 % (NT50) contre le SARS-CoV-2 1 mois après la dose 2 dans un sous-groupe de participants sélectionnés de façon aléatoire a démontré l’efficacité par extrapolation (« immunobridging ») des réponses immunitaires en comparant les enfants de 5 à 11 ans (c.-à-d. de 5 à moins de 12 ans) de la phase 2/3 de l’étude 3 aux participants âgés de 16 à 25 ans de la phase 2/3 de l’étude 2 qui ne présentaient aucune preuve sérologique ou virologique d’une infection antérieure par le SARS-CoV-2 jusqu’à 1 mois après la dose 2, remplissant les critères prédéfinis d’immunobridging aussi bien pour le ratio des moyennes géométriques des anticorps (RMG) que pour la différence entre les taux de réponse sérologique, la réponse sérologique étant établie sur la base de l’obtention d’une augmentation d’un facteur ≥ 4 du NT50 contre le SARS-CoV-2 par rapport à l’inclusion (avant la dose 1).
Le RMG du NT50 contre le SARS-CoV-2 1 mois après la dose 2 entre les enfants âgés de 5 à 11 ans (c.-à-d. de 5 à moins de 12 ans) et les jeunes adultes âgés de 16 à 25 ans a été de 1,04 (IC bilatéral à 95 % : 0,93 ; 1,18). Parmi les participants sans signes d’infection antérieure par le SARS-CoV-2 jusqu’à 1 mois après la dose 2, 99,2 % des enfants âgés de 5 à 11 ans et 99,2 % des participants âgés de 16 à 25 ans ont présenté une réponse sérologique 1 mois après la dose 2. La différence entre les 2 groupes d’âge (enfants et jeunes adultes) s’agissant des proportions de participants ayant présenté une réponse sérologique a été de 0,0 % (IC bilatéral à 95 % : -2,0 % ; 2,2 %). Cette information est présentée dans le tableau 9.
Tableau 9 : Résumé des ratios des moyennes géométriques pour le titre d’anticorps neutralisants à 50 % et différence de pourcentages de participants ayant présenté une réponse sérologique – comparaison entre les enfants âgés de 5 à 11 ans (étude 3) et les participants âgés de 16 à 25 ans (étude 2) – participants sans signe d’infection jusqu’à 1 mois après la dose 2 – sous-groupe d’immunobridging – phase 2/3 – population évaluable pour l’immunogénicité.
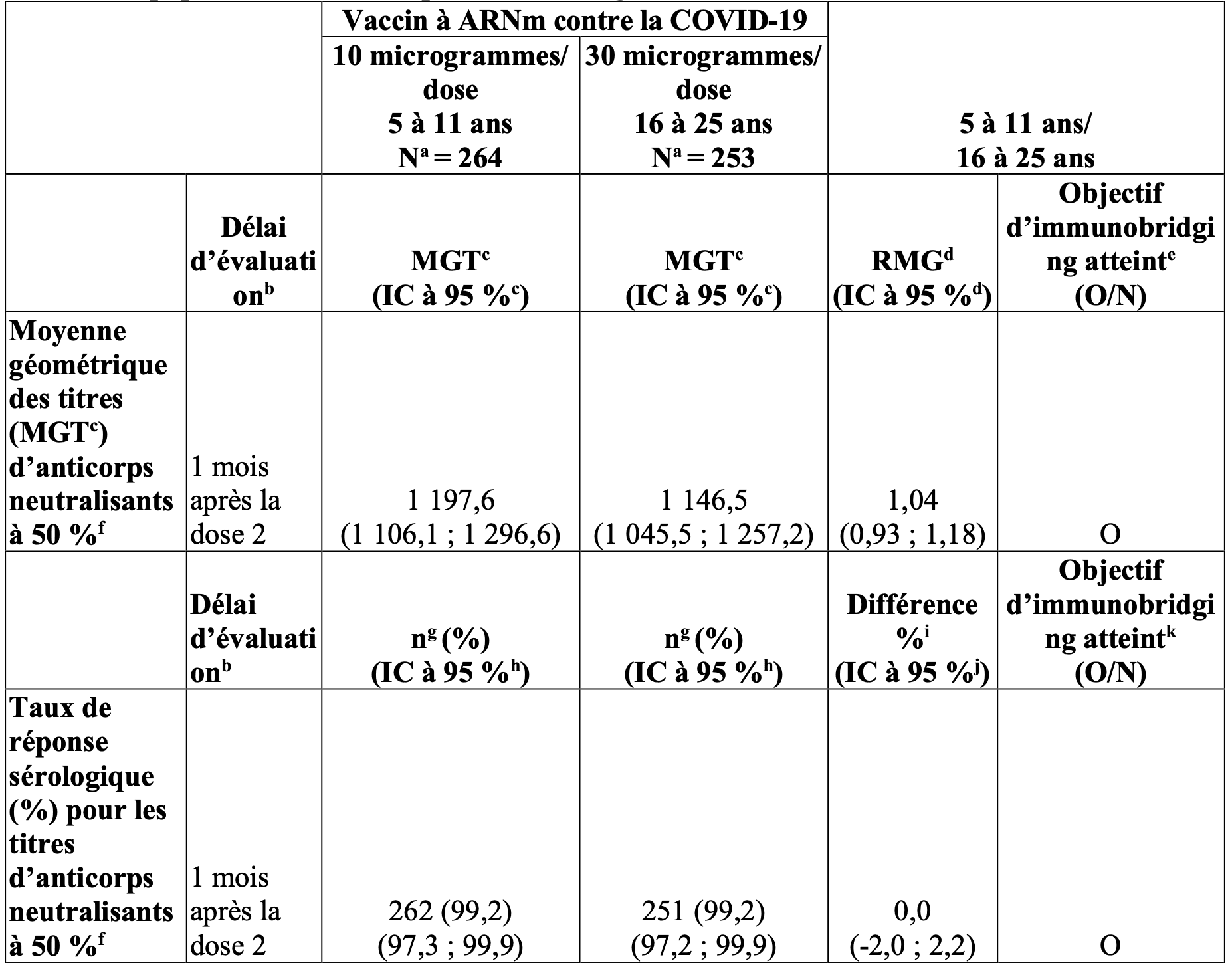
MGT = moyenne géométrique des titres ; LIQ = limite inférieure de quantification ; TAAN = test d’amplification des acides nucléiques ; NT50 = titre d’anticorps neutralisants à 50 % ; SARS‑CoV‑2 = coronavirus 2 responsable du syndrome respiratoire aigu sévère.
Remarque : Les participants ne présentant aucune preuve sérologique ou virologique (jusqu’à 1 mois après la prise de sang post-dose 2) d’une infection antérieure par le SARS-CoV-2 (c.-à-d. absence d’anticorps [sérique] fixant la protéine N lors de la visite de la dose 1 et 1 mois après la dose 2, et pas de détection du SARS-CoV-2 par le test TAAN [prélèvement nasal] lors des visites de la dose 1 et de la dose 2 et ayant eu un résultat négatif au test TAAN [prélèvement nasal] lors de toute visite non programmée jusqu’à 1 mois après la prise de sang de la dose 2) et sans antécédents médicaux de covid 19 ont été inclus dans l’analyse.
Remarque : la réponse sérologique est établie sur la base de l’obtention d’une augmentation d’un facteur ≥ 4 par rapport à l’inclusion (avant la dose 1). Si la mesure à l’inclusion est inférieure à la LIQ, un résultat du dosage post-vaccination ≥ 4 × LIQ est considéré comme une réponse sérologique.
a. N = nombre de participants disposant de résultats de test valides et déterminants avant la vaccination et 1 mois après la dose 2. Ces valeurs sont également les dénominateurs utilisés pour le calcul des taux de réponse sérologique.
b. Délai prévu dans le protocole pour le prélèvement des échantillons sanguins.
c. Les MGT et les IC bilatéraux à 95 % ont été calculés en exponentialisant le logarithme moyen des titres et les IC correspondants (sur la base de la distribution t de Student). Les résultats de test inférieurs à la LIQ ont été fixés à 0,5 × LIQ.
d. Les RMG et les IC bilatéraux à 95 % ont été calculés en exponentialisant la différence moyenne entre les logarithmes des titres (5 à 11 ans moins 16 à 25 ans) et l’IC correspondant (sur la base de la distribution t de Student).
e. L’immunobridging basé sur les MGT est déclaré si la limite inférieure de l’IC bilatéral à 95 % pour le RMG est supérieure à 0,67 et si la valeur estimée du RMG est ≥ 0,8.
f. Les NT50 contre le SARS-CoV-2 ont été déterminés à l’aide du test de microneutralisation du virus SARS-CoV-2 mNeonGreen. Le test utilise un virus rapporteur fluorescent dérivé de la souche USA_WA1/2020 et la neutralisation du virus est évaluée sur des monocouches de cellules Vero. Le NT50 de l’échantillon est défini comme la valeur réciproque de la dilution sérique à laquelle 50 % du virus est neutralisé.
g. n = nombre de participants présentant une réponse sérologique sur la base du NT50 1 mois après la dose 2.
h. IC bilatéral exact basé sur la méthode de Clopper-Pearson.
i. Différence entre les proportions, exprimée en pourcentage (5 à 11 ans moins 16 à 25 ans).
j. IC bilatéral, basé sur la méthode de Miettinen et Nurminen pour la différence entre les proportions, exprimée en pourcentage.
k. L’immunobridging basé sur le taux de réponse sérologique est déclaré si la limite inférieure de l’IC bilatéral à 95 %, pour la différence de réponse sérologique, est supérieure à -10,0 %.
Immunogénicité chez les enfants âgés de 5 à 11 ans (c.-à-d. de 5 à moins de 12 ans) – après la dose de rappel
Une dose de rappel de Comirnaty a été administrée à 401 participants de l’étude 3 sélectionnés de façon aléatoire. L’efficacité de la dose de rappel chez les enfants de 5 à 11 ans est extrapolée à partir des données d’immunogénicité. L’immunogénicité de cette dose a été évaluée sur la base du NT50 contre la souche de référence du SARS-CoV-2 (USA_WA1/2020). Les analyses des NT50 1 mois après la dose de rappel comparés à ceux mesurés avant la dose de rappel ont montré une augmentation importante des MGT chez les personnes âgées de 5 à 11 ans qui n’avaient aucune preuve sérologique ou virologique d’une infection antérieure par le SARS-CoV-2 jusqu’à 1 mois après la dose 2 et la dose de rappel. Cette analyse est résumée dans le tableau 10.
Tableau 10 : Résumé des moyennes géométriques des titres – NT50 – participants sans signe d’infection – phase 2/3 – groupe d’évaluation de l’immunogénicité – enfants de 5 à 11 ans – population évaluable pour l’immunogénicité.
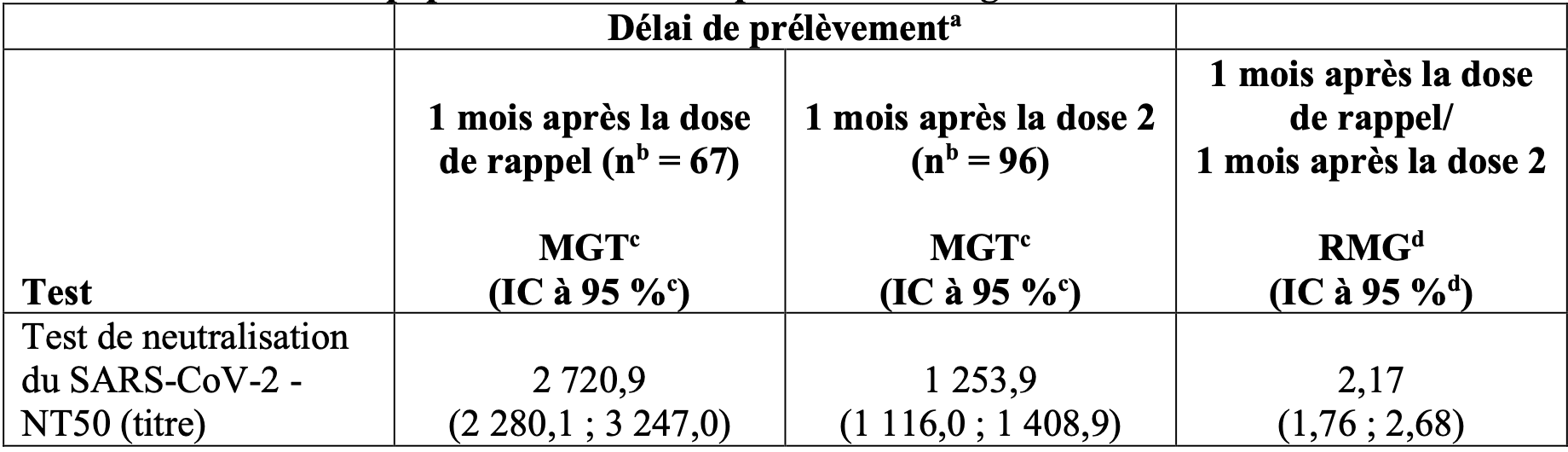
MGT = moyenne géométrique des titres ; LIQ = limite inférieure de quantification ; NT50 = titre d’anticorps neutralisants à 50 % ; SARS-CoV-2 = coronavirus 2 responsable du syndrome respiratoire aigu sévère.
a. Délai prévu dans le protocole pour le prélèvement des échantillons sanguins.
b. n = nombre de participants disposant de résultats de test valides et déterminants pour le test indiqué lors de la dose indiquée/au moment prévu pour le prélèvement.
c. Les MGT et les IC bilatéraux à 95 % ont été calculés en exponentialisant le logarithme moyen des titres et les IC correspondants (sur la base de la distribution t de Student). Les résultats de test inférieurs à la LIQ ont été fixés à 0,5 × LIQ.
d. Les RMG et les IC bilatéraux à 95 % ont été calculés en exponentialisant la différence moyenne entre les logarithmes des titres (1 mois après la dose de rappel moins 1 mois après la dose 2) et l’IC correspondant (sur la base de la distribution t de Student).
Efficacité et immunogénicité d’un schéma de primo-vaccination de 3 doses chez les nourrissons et les enfants âgés de 6 mois à 4 ans
L’analyse de l’efficacité, dans l’étude 3, a été réalisée sur la population totale des participants âgés de 6 mois à 4 ans, sur la base des cas confirmés parmi les 873 participants du groupe vaccin à ARNm contre la covid 19 et les 381 participants du groupe placebo (rapport de randomisation de 2/1) ayant reçu la totalité des 3 doses du vaccin de l’étude pendant la période de suivi en aveugle à un moment où le variant Omicron du SARS-CoV-2 (BA.2) était le principal variant en circulation (date limité de prise en compte des données : 17 juin 2022).
Les résultats concernant l’efficacité du vaccin après la troisième dose chez les participants âgés de 6 mois à 4 ans sont présentés dans le tableau 11.
Tableau 11 : Efficacité du vaccin – premier épisode de la covid 19 à partir de 7 jours après la dose 3 – période de suivi en aveugle – participants sans infection antérieure avant le délai de 7 jours après la dose 3 – phase 2/3 – âge de 6 mois à 4 ans – population évaluable pour l’efficacité (3 doses).

EV = efficacité du vaccin.
* Les participants ne présentant aucun critère sérologique ou virologique (avant le délai de 7 jours après avoir reçu la dose 3) d’une infection antérieure par le SARS-CoV-2 (c.-à-d. absence d’anticorps [sérique] fixant la protéine N lors des visites de la dose 1, 1 mois après la dose 2 (si disponible) et de la dose 3 (si disponible), sans détection de SARS-CoV-2 par le test NAAT [prélèvement nasal] lors des visites d’étude de la dose 1, de la dose 2 et de la dose 3, et ayant eu un résultat négatif au test NAAT [prélèvement nasal] lors de toute visite non programmée avant le délai de 7 jours après la dose 3) et sans antécédents médicaux de covid 19 ont été inclus dans l’analyse.
a. N = nombre de participants dans le groupe indiqué.
b. n1 = nombre de participants répondant à la définition du critère d’évaluation.
c. Durée de surveillance totale en 1 000 personne-années pour le critère d’évaluation indiqué sur l’ensemble des participants au sein de chaque groupe à risque pour le critère d’évaluation. La période de temps pour le cumul
des cas de covid 19 s’étend de 7 jours après la dose 3 jusqu’à la fin de la période de surveillance.
d. n2 = nombre de participants à risque pour le critère d’évaluation.
e. L’intervalle de confiance (IC) bilatéral à 95 % pour l’EV est issu de la méthode de Clopper-Pearson avec ajustement en fonction de la durée de surveillance.
Chez les participants avec ou sans infection antérieure par le SARS‑CoV‑2, l’efficacité du vaccin a été similaire à celle observée chez les participants sans infection antérieure par le SARS‑CoV‑2.
Les critères d’une covid 19 sévère (tels que décrits dans le protocole, d’après la définition de la FDA, adaptée pour les enfants) ont été remplis dans 12 cas (8 ayant reçu le vaccin à ARNm contre la covid 19 et 4 ayant reçu le placebo) parmi les participants âgés de 6 mois à 4 ans. Parmi les participants âgés de 6 mois à 23 mois, les critères d’une covid 19 sévère ont été remplis dans 3 cas (2 ayant reçu le vaccin à ARNm contre la covid 19 et 1 ayant reçu le placebo).
Les analyses de l’immunogénicité ont été réalisées dans le sous-groupe d’immunobridging constitué de 82 participants à l’étude 3 âgés de 6 à 23 mois et de 143 participants à l’étude 3 âgés de 2 à 4 ans, sans signe d’infection jusqu’à 1 mois après la dose 3, sur la base des données recueillies jusqu’à la date limite du 29 avril 2022.
Les titres d’anticorps neutralisants à 50 % (NT50) contre le SARS-CoV-2 ont été comparés entre un sous-groupe d’évaluation de l’immunogénicité, constitué de participants à l’étude 3 de phase 2/3 âgés de 6 à 23 mois et de 2 à 4 ans évalués 1 mois après les 3 doses du schéma de primo-vaccination, et un sous-groupe sélectionné de façon aléatoire dans l’étude 2 de phase 2/3 parmi les participants âgés de 16 à 25 ans évalués 1 mois après les 2 doses du schéma de primo-vaccination, en utilisant un test de microneutralisation contre la souche de référence (USA_WA1/2020).
Les analyses primaires d’immunobridging ont comparé la moyenne géométrique des titres (en utilisant le ratio des moyennes géométriques des titres [RMG]) et les taux de réponse sérologique (établie sur la base de l’obtention d’une augmentation d’un facteur ≥ 4 du NT50 contre le SARS-CoV-2 comparé à avant la dose 1) au sein de la population des participants évaluables pour l’immunogénicité sans signe d’infection antérieure par le SARS-CoV-2 jusqu’à 1 mois après la dose 3 chez les participants âgés de 6 à 23 mois et de 2 à 4 ans, et jusqu’à 1 mois après la dose 2 chez les participants âgés de 16 à 25 ans. Les critères prédéfinis d’immunobridging ont été remplis, aussi bien pour le RMG que pour la différence entre les taux de réponse sérologique, dans les deux groupes d’âge (tableau 12).
Tableau 12 : MGT (NT50) contre le SARS-CoV-2 et différence de pourcentages des participants ayant présenté une réponse sérologique 1 mois après le schéma de vaccination – sous-groupe d’immunobridging - participants âgés de 6 mois à 4 ans (étude 3) 1 mois après la dose 3 et participants âgés de 16 à 25 ans (étude 2) 1 mois après la dose 2 – sans signe d’infection par le SARS-CoV-2 – population évaluable pour l’immunogénicité.
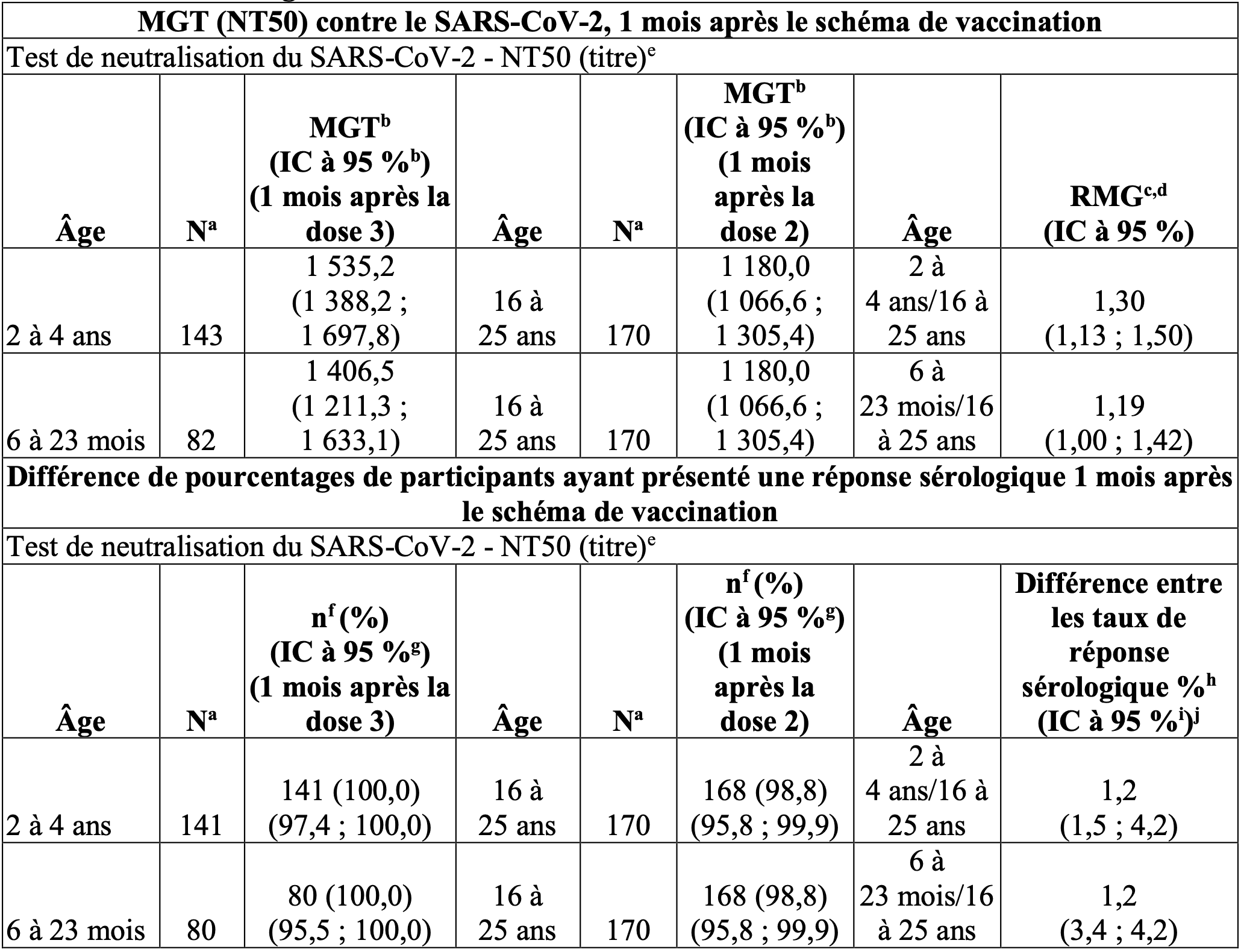
MGT = moyenne géométrique des titres ; LIQ = limite inférieure de quantification ; TAAN = test d’amplification des acides nucléiques ; fixant la protéine N = fixant la nucléoprotéine du SARS‑CoV‑2 ;
NT50 = titre d’anticorps neutralisants à 50 % ; SARS‑CoV‑2 = coronavirus 2 responsable du syndrome respiratoire aigu sévère.
Remarque : les participants ne présentant aucun critère sérologique ou virologique (jusqu’à 1 mois après la prise de sang post-dose 2 [étude 2] ou jusqu’à 1 mois après la prise de sang post-dose 3 [étude 3]) d’une infection antérieure par le SARS‑CoV‑2 (c.-à-d. absence d’anticorps [sérique] fixant la protéine N lors des visites de la dose 1, de la dose 3 (étude 3) et 1 mois après la dose 2 [étude 2] ou 1 mois après la dose 3 [étude 3], sans détection de SARS‑CoV‑2 par le test TAAN [prélèvement nasal] lors des visites d’étude de la dose 1, de la dose 2 et de la dose 3 [étude 3], et ayant eu un résultat négatif au test TAAN [prélèvement nasal] lors de toute visite non programmée jusqu’à 1 mois après la dose 2 [étude 2] ou 1 mois après la dose 3 [étude 3] avec prise de sang]) et sans antécédents médicaux de covid 19 ont été inclus dans l’analyse.
Remarque : la réponse sérologique est établie sur la base de l’obtention d’une augmentation d’un facteur ≥ 4 par rapport à l’inclusion (avant la dose 1). Si la mesure à l’inclusion est inférieure à la LIQ, un résultat du dosage post-vaccination ≥ 4 × LIQ est considéré comme une réponse sérologique.
a. N = nombre de participants disposant de résultats de test valides et déterminants pour le test indiqué lors de la dose indiquée/du moment de prélèvement indiqué pour les MGT et nombre de participants disposant de résultats de test valides et déterminants pour le test indiqué aussi bien à l’inclusion que lors de la dose indiquée/du moment de prélèvement indiqué pour les taux de réponse sérologique.
b. Les MGT et les IC bilatéraux à 95 % ont été calculés en exponentialisant le logarithme moyen des titres et les IC correspondants (sur la base de la distribution t de Student). Les résultats de test inférieurs à la LIQ ont été fixés à 0,5 × LIQ.
c. Les RMG et les IC bilatéraux à 95 % ont été calculés en exponentialisant la différence moyenne entre les logarithmes des titres (groupe des plus jeunes moins les 16 à 25 ans) et l’IC correspondant (sur la base de la distribution t de Student).
d. Pour chacun des deux groupes de participants plus jeunes (2 à 4 ans, 6 à 23 mois), l’immunobridging basé sur le RMG est déclaré si la limite inférieure de l’IC bilatéral à 95 % pour le RMG est supérieure à 0,67 et si la valeur estimée du RMG est ≥ 0,8.
e. Les NT50 contre le SARS-CoV-2 ont été déterminés à l’aide du test de microneutralisation du virus SARS-CoV-2 mNeonGreen. Le test utilise un virus rapporteur fluorescent dérivé de la souche USA_WA1/2020 et la neutralisation du virus est évaluée sur des monocouches de cellules Vero. Le NT50 de l’échantillon est défini comme la valeur réciproque de la dilution sérique à laquelle 50 % du virus est neutralisé.
f. n = nombre de participants présentant une réponse sérologique pour le test indiqué lors de la dose indiquée/du moment de prélèvement indiqué.
g. IC bilatéral exact basé sur la méthode de Clopper-Pearson.
h. Différence entre les proportions, exprimée en pourcentage (groupe des plus jeunes moins les 16 à 25 ans).
i. IC bilatéral, basé sur la méthode de Miettinen et Nurminen pour la différence entre les proportions, exprimée en pourcentage.
j. Pour chacun des deux groupes de participants plus jeunes (2 à 4 ans, 6 à 23 mois), l’immunobridging basé sur la réponse sérologique est déclaré si la limite inférieure de l’IC bilatéral à 95 % pour la différence entre les proportions est supérieure à -10,0 %, sous réserve que les critères d’immunobridging basés sur le RMG soient remplis.
Immunogénicité chez les participants immunodéprimés (adultes et enfants)
L’étude 10, une étude de phase IIb en ouvert (n = 124), a inclus des patients immunodéprimés âgés de 2 à moins de 18 ans qui recevaient un traitement immunomodulateur, ou qui avaient reçu une greffe d’organe solide (dans les 3 mois précédents) et recevaient un traitement immunosuppresseur, ou qui avaient reçu une greffe de moelle osseuse ou de cellules souches au moins 6 mois avant l’inclusion, et des patients immunodéprimés âgés de 18 ans et plus qui étaient traités pour un cancer du poumon non à petites cellules (CPNPC) ou pour une leucémie lymphoïde chronique (LLC), qui étaient sous hémodialyse en raison d’une insuffisance rénale terminale, ou qui recevaient un traitement immunomodulateur pour une maladie auto-immune inflammatoire. Les participants ont reçu 4 doses de Comirnaty adaptées à leur âge (3 microgrammes, 10 microgrammes ou 30 microgrammes). Les 2 premières doses étaient espacées de 21 jours, la dose 3 était administrée 28 jours après la dose 2, et la dose 4 était administrée 3 à 6 mois après la dose 3.
L’analyse des données d’immunogénicité à 1 mois après la dose 3 (26 participants âgés de 2 à moins de 5 ans, 56 participants âgés de 5 à moins de 12 ans, 11 participants âgés de 12 à moins de 18 ans, et 4 participants âgés de 18 ans et plus) et à 1 mois après la dose 4 (16 participants âgés de 2 à moins de 5 ans, 31 participants âgés de 5 à moins de 12 ans, 6 participants âgés de 12 à moins de 18 ans, et 4 participants âgés de 18 ans et plus) dans la population évaluable pour l’immunogénicité sans infection antérieure, a mis en évidence une réponse immunitaire induite par le vaccin. Les MGT avaient fortement augmenté 1 mois après la dose 3, étaient encore plus élevées 1 mois après la dose 4 et restaient élevées 6 mois après la dose 4, en comparaison avec les niveaux observés avant la vaccination dans le cadre de l’étude, dans tous les groupes d’âge et sous-groupes de maladies.
3. Population pédiatrique
L’Agence européenne des médicaments a différé l’obligation de soumettre les résultats d’études réalisées avec Comirnaty dans la population pédiatrique pour la prévention de la covid 19 (voir rubrique "Posologie" pour les informations concernant l’usage pédiatrique).
Conservation
À conserver au congélateur entre -90 °C et -60 °C.
À conserver dans l’emballage d’origine, à l’abri de la lumière.
Durant la conservation, limiter autant que possible l’exposition à l’éclairage intérieur et éviter toute exposition à la lumière directe du soleil et aux rayons ultraviolets.
Flacons non ouverts
Le vaccin sera reçu congelé entre ‑90 °C et ‑60 °C.
Lors de sa réception, le vaccin congelé peut être conservé entre -90 °C et -60 °C ou entre 2 °C et 8 °C.
18 mois en cas de conservation entre -90 °C et -60 °C.
Dans la limite de leur durée de conservation de 18 mois, les flacons décongelés (précédemment congelés) peuvent être conservés entre 2 °C et 8 °C pendant un maximum de 10 semaines.
Procédure de décongélation
S’il est conservé congelé entre ‑90 °C et ‑60 °C, le plateau de 10 flacons unidoses de vaccin peut être décongelé en étant placé entre 2 °C et 8 °C pendant 2 heures ou les flacons peuvent être décongelés individuellement à température ambiante (jusqu’à 30 °C) pendant 30 minutes.
Flacons décongelés (précédemment congelés)
Conservation et transport sur une durée de 10 semaines entre 2 °C et 8 °C dans la limite des 18 mois de conservation.
- Lorsque le vaccin est placé à une température de 2 °C à 8 °C pour être conservé, la nouvelle date de péremption doit être notée sur l’emballage extérieur et le vaccin doit être utilisé avant cette nouvelle date de péremption ou être éliminé. L’ancienne date de péremption doit être barrée.
- Si le vaccin est reçu à une température de 2 °C à 8 °C, il doit être conservé entre 2 °C et 8 °C. La date de péremption indiquée sur l’emballage extérieur doit alors avoir été mise à jour pour tenir compte de la nouvelle date de péremption correspondant à la conservation au réfrigérateur et l’ancienne date de péremption doit avoir été barrée.
Avant utilisation, les flacons non ouverts peuvent être conservés pendant un maximum de 12 heures entre 8 °C et 30 °C.
Les flacons décongelés peuvent être manipulés dans des conditions d’éclairage intérieur.
Une fois décongelé, le vaccin ne doit pas être recongelé.
Gestion des écarts de température pendant la conservation au réfrigérateur :
- Les données de stabilité indiquent que le flacon non ouvert reste stable sur une durée allant jusqu’à 10 semaines lorsqu’il est conservé à des températures de ‑2 °C à 2 °C, dans la limite des 10 semaines de conservation entre 2° C et 8 °C.
- Les données de stabilité indiquent que le flacon peut être conservé pendant un maximum de 24 heures à des températures de 8 °C à 30 °C, dont un maximum de 12 heures après la première ponction.
Ces informations visent uniquement à orienter les professionnels de santé en cas d’un écart temporaire de température.
Médicament dilué
Après dilution dans une solution injectable de chlorure de sodium à 9 mg/mL (0,9 %), la stabilité physico-chimique en cours d’utilisation a été démontrée pendant 12 heures entre 2 °C et 30 °C en tenant compte d’une durée de transport maximale de 6 heures. D’un point de vue microbiologique, à moins que la méthode de dilution permette d’exclure tout risque de contamination microbienne, le produit doit être utilisé immédiatement. À défaut d’une utilisation immédiate, les durées et conditions de conservation en cours d’utilisation relèvent de la responsabilité de l’utilisateur.
Manipulation
Instructions de manipulation avant utilisation
Comirnaty KP.2 doit être préparé par un professionnel de santé en respectant les règles d’asepsie pour préserver la stérilité de la solution préparée.
Instructions relatives aux flacons unidoses et multidoses
- Vérifier que le flacon est muni d’un couvercle en plastique jaune et que le nom du produit est bien Comirnaty KP.2 3 microgrammes/dose dispersion à diluer pour dispersion injectable (nourrissons et enfants de 6 mois à 4 ans).
- Si un autre nom de produit est indiqué sur l’étiquette du flacon, veuillez vous reporter au Résumé des caractéristiques du produit correspondant à cette formulation.
- Si le flacon est conservé congelé, il doit être décongelé avant utilisation. Pour la décongélation, les flacons congelés doivent être placés à une température de 2 °C à 8 °C ; pour une boîte de 10 flacons, la décongélation pourra prendre 2 heures. Veiller à ce que les flacons soient totalement décongelés avant utilisation.
- Lorsque les flacons sont placés à une température de 2 °C à 8 °C pour être conservés, la date de péremption doit être actualisée sur l’emballage.
- Les flacons non ouverts peuvent être conservés pendant un maximum de 10 semaines entre 2 °C et 8 °C, sans dépasser la date de péremption imprimée (EXP).
- Les flacons congelés peuvent également être décongelés individuellement à une température allant jusqu’à 30 °C pendant 30 minutes.
- Avant utilisation, le flacon non ouvert peut être conservé pendant un maximum de 12 heures à des températures allant jusqu’à 30 °C. Les flacons décongelés peuvent être manipulés dans des conditions d’éclairage intérieur.
Dilution
- Laisser le flacon décongelé se réchauffer à température ambiante et le retourner délicatement à 10 reprises avant la dilution. Ne pas secouer.
- Avant la dilution, la dispersion décongelée peut contenir des particules amorphes opaques de couleur blanche à blanc cassé.
- Le vaccin décongelé doit être dilué dans son flacon d’origine à l’aide de 1,1 mL de solution injectable de chlorure de sodium à 9 mg/mL (0,9 %), en utilisant une aiguille de calibre 21 G (gauge) ou plus fine et en respectant les règles d’asepsie.
- Avant de retirer l’aiguille du bouchon du flacon, équilibrer la pression du flacon en aspirant 1,1 mL d’air dans la seringue de diluant vide.
- Retourner délicatement la solution diluée à 10 reprises. Ne pas secouer.
- Le vaccin dilué doit avoir l’aspect d’une dispersion limpide à légèrement opalescente, exempte de particules visibles. Ne pas utiliser le vaccin dilué si la présence de particules ou une coloration anormale sont observées.
- La date et l’heure de l’expiration de la solution diluée doivent être inscrites sur les flacons dilués.
- Après dilution, le produit doit être conservé entre 2 °C et 30 °C et être utilisé dans les 12 heures.
- Ne pas congeler ni secouer la solution diluée. Si elle est conservée au réfrigérateur, laisser la solution diluée atteindre la température ambiante avant de l’utiliser.
Préparation des doses de 0,3 mL
- Après dilution, le flacon contient 1,58 mL, ce qui permet d’extraire 3 doses de 0,3 mL.
- En utilisant une technique aseptique, nettoyer le bouchon du flacon à l’aide d’une compresse à usage unique imprégnée d’antiseptique.
- Prélever 0,3 mL de Comirnaty KP.2 pour les nourrissons et les enfants âgés de 6 mois à 4 ans.
Des aiguilles et/ou seringues classiques peuvent être utilisées pour extraire les 3 doses d’unflacon unique. - Chaque dose doit contenir 0,3 mL de vaccin.
- Si la quantité de vaccin restant dans le flacon ne permet pas d’obtenir une dose complète de 0,3 mL, jeter le flacon et la solution résiduelle.
- Éliminer tout vaccin non utilisé dans les 12 heures suivant la dilution.
Ce médicament ne doit pas être mélangé avec d’autres médicaments.
Élimination
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Autres informations
Pour en savoir plus : site du fabricant Pfizer-BioNtech sur le vaccin Comirnaty.
Données de sécurité préclinique
Les données non cliniques issues des études conventionnelles de toxicologie en administration répétée, et des fonctions de reproduction et de développement n’ont pas révélé de risque particulier pour l’homme.
Toxicologie générale
Des rats exposés au vaccin Comirnaty par voie intramusculaire (3 injections de la dose humaine, à une semaine d’intervalle, conduisant à des niveaux d’exposition plus élevés chez le rat du fait des différences de poids corporel) ont présenté des œdèmes et érythèmes au site d’injection, des augmentations des globules blancs (notamment des basophiles et éosinophiles) caractéristiques d’une réponse inflammatoire, ainsi qu’une vacuolisation des hépatocytes de la région portale sans signe de lésion hépatique associé. Tous les effets ont été réversibles.
Génotoxicité/cancérogénicité
Aucune étude de génotoxicité ou de cancérogénicité n’a été réalisée. Il n’est pas attendu que les composants du vaccin (lipides et ARNm) présentent un potentiel génotoxique.
Toxicité sur la reproduction
La toxicité sur les fonctions de reproduction et de développement a été évaluée chez le rat dans une étude de toxicologie combinée sur la fertilité et le développement, durant laquelle des rates ont été exposées au vaccin Comirnaty, par voie intramusculaire, avant l’accouplement et durant la gestation (4 injections de la dose humaine induisant des niveaux d’exposition plus élevés chez le rat du fait des différences de poids corporel, s’étalant depuis le jour 21 avant l’accouplement jusqu’au jour 20 de la gestation). Une réponse en anticorps neutralisants dirigés contre le SARS-CoV-2 était présente avant l’accouplement jusqu’à la fin de l’étude, au jour 21 post-natal, et également chez les fœtus et chez la progéniture au 21e jour post-natal.
Il n’a pas été observé d’effet lié au vaccin sur la fertilité des femelles, la gestation ou le développement de l’embryon/fœtus ou de la progéniture. Il n’y a pas de donnée disponible concernant le transfert placentaire du vaccin Comirnaty ou son excrétion dans le lait maternel.