NIMENRIX
Laboratoire : Pfizer
Arrêté du 18 février 2026 : le rattrapage vaccinal est pris en charge pour les enfants nés en 2020, 2021 ou 2022.
De nouvelles recommandations sur le rattrapage vaccinal ont été publiées en mars 2025 en raison d'une recrudescence des infections invasives à méningocoques : un rattrapage vaccinal jusqu’à 5 ans est recommandé chez les enfants n’ayant pas été vaccinés contre les sérogroupes ACWY.
Depuis le 1er décembre 2024, ce vaccin est remboursé dans le cadre des nouvelles recommandations (vaccination du nourrisson et de l'adolescent, avec un rattrapage jusqu'à l'âge de 24 ans inclus).
Description
Vaccin polyosidique conjugué quadrivalent contre les méningocoques des sérogroupes A, C, W et Y (conjugué à l'anatoxine tétanique).
Forme et Présentation
Nimenrix poudre et solvant pour solution injectable en seringue préremplie.
Poudre et solvant pour solution injectable.
La poudre ou la poudre agglomérée est blanche.
Le solvant est transparent et incolore.
Nature et contenu de l'emballage extérieur
- Poudre en flacon (verre de type I) muni d'un bouchon (caoutchouc butyle) et solvant en seringue préremplie munie d'un piston (caoutchouc butyle).
Présentations de 1 et 10 avec ou sans aiguilles.
Toutes les présentations peuvent ne pas être commercialisées.
Composition
Une dose (0,5 mL) contient après reconstitution :
1. Antigène
- Polyoside de Neisseria meningitidis de groupe A 1 : 5 microgrammes
- Polyoside de Neisseria meningitidis de groupe C 1 : 5 microgrammes
- Polyoside de Neisseria meningitidis de groupe W135 1 : 5 microgrammes
- Polyoside de Neisseria meningitidis de groupe Y 1 : 5 microgrammes
2. Autres composants
Poudre :
- Saccharose
- Trométamol
Solvant :
- Chlorure de sodium *
- Eau pour préparations injectables
Indications
Nimenrix est indiqué dans l’immunisation active des sujets à partir de 6 semaines contre les maladies méningococciques invasives dues aux Neisseria meningitidis des groupes A, C, W135 et Y.
Posologie
Nimenrix doit être utilisé selon les recommandations officielles disponibles.
1. Primovaccination
Nourrissons âgés de 6 semaines à moins de 6 mois
- deux doses, chacune de 0,5 mL, doivent être administrées en respectant un intervalle de 2 mois entre les deux doses.
Nourrissons à partir de 6 mois, enfants, adolescents et adultes
- une dose unique de 0,5 mL doit être administrée.
Une dose de primovaccination supplémentaire de Nimenrix peut être jugée appropriée chez certains sujets (voir rubrique "Mise en garde et précautions d'emploi").
2. Doses de rappel
Les données sur la persistance à long terme des anticorps après la vaccination par Nimenrix sont disponibles jusqu’à 10 ans après la vaccination (voir rubriques "Mise en garde et précautions d'emploi" et "Pharmacodynamie").
Une fois le schéma de primovaccination terminé chez les nourrissons âgés de 6 semaines à moins de 12 mois, une dose de rappel doit être administrée à l'âge de 12 mois en respectant un intervalle d'au moins 2 mois après la dernière vaccination par Nimenrix (voir rubrique "Pharmacodynamie").
Chez les sujets âgés de 12 mois et plus précédemment vaccinés, une dose de rappel de Nimenrix peut être administrée s'ils ont reçu une primovaccination avec un vaccin méningococcique polyosidique conjugué ou non conjugué ( voir rubriques "Mise en garde et précautions d'emploi" et "Pharmacodynamie").
Mode d'administration
La vaccination doit être effectuée par injection intramusculaire seulement.
Chez les nourrissons, le site d’injection recommandé est la partie antérolatérale de la cuisse. Chez les personnes à partir de 1 an, le site d’injection recommandé est la partie antérolatérale de la cuisse ou le muscle deltoïde (voir les rubriques "Mises en garde et précautions d'emploi" et "Interactions").
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique "Manipulation".
Contre-indications
Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique "Composition".
Mises en garde et précautions d'emploi
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Nimenrix ne doit en aucun cas être administré par voie intravasculaire, intradermique ou sous-cutanée.
Conformément aux bonnes pratiques cliniques, la vaccination doit être précédée d’une évaluation des antécédents médicaux (en particulier des vaccinations antérieures et de l’éventuelle apparition d’effets indésirables) et d’un examen clinique.
Il est recommandé de toujours disposer d’un traitement médical approprié et d’assurer une surveillance, dans le cas rare où surviendrait une réaction anaphylactique suivant l’administration du vaccin.
Maladie intercurrente
La vaccination par Nimenrix doit être différée chez les sujets souffrant d’une maladie fébrile sévère aiguë. La présence d'une infection bénigne, comme un rhume, ne doit pas conduire à un report de la vaccination.
Syncope
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l’injection avec une aiguille. Ceci peut s’accompagner de plusieurs symptômes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d’éviter des blessures en cas d’évanouissement.
Thrombocytopénie et troubles de la coagulation
Nimenrix doit être administré avec précaution chez les sujets présentant une thrombocytopénie ou un trouble de la coagulation en raison du risque de saignement qui peut survenir suite à l’administration intramusculaire du vaccin chez ces sujets.
Immunodéficience
Une réponse immunitaire adéquate peut ne pas être obtenue chez les patients recevant un traitement immunosuppresseur ou chez les patients immunodéprimés.
Les personnes présentant des déficits familiaux en complément (par exemple, des déficits en C5 ou C3) et les personnes recevant des traitements inhibant l'activation terminale du complément (par exemple, l'éculizumab) ont un risque accru de maladie invasive due à Neisseria meningitidis des sérogroupes A, C, W135 et Y, même si elles développent des anticorps après la vaccination avec Nimenrix.
Protection contre les infections méningococciques
Nimenrix protègera uniquement contre Neisseria meningitidis des groupes A, C, W135 et Y. Le vaccin ne protègera pas contre les autres groupes de Neisseria meningitidis.
Une réponse immunitaire protectrice peut ne pas être obtenue chez tous les sujets vaccinés.
Effet des immunisations antérieures avec un vaccin méningococcique polyosidique
Les sujets ayant antérieurement reçu un vaccin méningococcique polyosidique non conjugué et vaccinés par Nimenrix 30 à 42 mois plus tard ont eu des Moyennes Géométriques des Titres en anticorps (MGT), mesurées par un test d’activité sérique bactéricide utilisant du complément de lapin (rSBA), plus faibles que les sujets n’ayant pas reçu de vaccin méningococcique dans les 10 années précédentes (voir rubrique "Pharmacodynamie"). La pertinence clinique de cette observation est inconnue.
Effet des anticorps anti toxine tétaniques pré-vaccinaux
La tolérance et l’immunogénicité de Nimenrix ont été évaluées lorsqu’il était administré séquentiellement ou coadministré avec un vaccin contenant les anatoxines diphtériques et tétaniques, la coqueluche acellulaire, le virus poliomyélitique inactivé (type 1, 2 et 3), l’antigène de surface de l’hépatite B et l’Haemophilus influenzae type b phosphate de polyribosylribitol conjugué à l’anatoxine tétanique (DTCaP-HepB/Hib) durant la seconde année de vie. L’administration de Nimenrix un mois après le vaccin DTCaP-HepB/Hib a conduit à des MGT rSBA contre les groupes A, C et W135 plus faibles par rapport à la co-administration (voir rubrique "Interactions"). La pertinence clinique de cette observation est inconnue.
Réponse immunitaire chez les nourrissons âgés de 6 mois à moins de 12 mois
Une dose unique administrée à 6 mois a été associée à des titres plus faibles du test d'activité sérique bactéricide utilisant du complément humain (hSBA) pour les groupes W-135 et Y, comparativement à trois doses administrées à 2, 4 et 6 mois (voir rubrique "Pharmacodynamie"). La pertinence clinique de cette observation est inconnue. Si un nourrisson âgé de 6 mois à moins de 12 mois est supposé être exposé à un risque particulier de maladie méningococcique invasive due à une exposition aux groupes W-135 et/ou Y, il peut être envisagé d'administrer une seconde dose de primovaccination de Nimenrix après un intervalle de 2 mois.
Réponses immunitaires chez les enfants en bas-âge âgés de 12 à 14 mois
Les enfants en bas-âge âgés de 12 à 14 mois présentaient des réponses rSBA similaires aux groupes A, C, W-135 et Y un mois après une dose de Nimenrix ou un mois après deux doses de Nimenrix administrées à deux mois d’intervalle.
Une dose unique était associée à des titres hSBA (test d’activité sérique bactéricide utilisant du complément humain) plus faibles aux groupes W-135 et Y par rapport aux deux doses administrées à deux mois d’intervalle. Des réponses similaires aux groupes A et C ont été observées après une ou deux doses (voir rubrique "Pharmacodynamie"). La pertinence clinique de ces données est inconnue. Si un enfant en bas-âge est jugé particulièrement à risque de développer une infection méningococcique invasive après l’exposition aux groupes W-135 et Y, il peut être envisagé d’administrer une deuxième dose de Nimenrix après un intervalle de deux mois. Concernant la décroissance des anticorps dirigés contre les groupes A et C après une première dose de Nimenrix chez les enfants âgés de 12 à 23 mois, voir Persistance des titres en anticorps sériques bactéricides.
Persistance des titres en anticorps sériques bactéricides
Suite à l’administration de Nimenrix il y a une décroissance des titres en anticorps sériques bactéricides contre le groupe A quand le test a utilisé du complément humain (hSBA) (voir rubrique "Pharmacodynamie"). La pertinence clinique de la décroissance des titres en anticorps hSBA contre le groupe A est inconnue. Cependant, si un sujet est considéré particulièrement à risque d’exposition au groupe A et a reçu une dose de Nimenrix environ plus d’un an auparavant, l’administration d’une dose de rappel peut être envisagée.
Une diminution des titres en anticorps a été observée au fil du temps pour les groupes A, C, W-135 et Y. La pertinence clinique de cette décroissance des titres en anticorps est inconnue. Une dose de rappel pourra être envisagée chez les sujets vaccinés en bas-âge et restant exposés à un risque élevé de maladies méningococciques dues aux groupes A, C, W-135 ou Y (voir rubrique "Pharmacodynamie").
Effet de Nimenrix sur les concentrations en anticorps anti-tétaniques
Bien qu’une augmentation des concentrations en anticorps anti toxine tétanique (TT) ait été observée après la vaccination avec Nimenrix, Nimenrix ne se substitue pas à la vaccination antitétanique.
L’administration de Nimenrix de façon concomitante ou un mois avant un vaccin contenant de la TT durant la seconde année de vie n’altère pas la réponse à la TT et n’affecte pas significativement la tolérance. Aucune donnée n’est disponible chez les sujets de plus de 2 ans.
Teneur en sodium
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
Interactions
Chez les nourrissons, Nimenrix peut être coadministré avec les vaccins combinés DTCaP-HepB/Hib et avec le vaccin pneumococcique conjugué 10-valent.
À partir de 1 an et plus, Nimenrix peut être coadministré avec les vaccins suivants : vaccins hépatite A (HepA) et hépatite B (HepB), vaccin rougeole-oreillon-rubéole (ROR), vaccin rougeole-oreillonrubéole- varicelle (RORV), vaccin pneumococcique conjugué 10-valent ou vaccin grippal saisonnier sans adjuvant.
Durant la seconde année de vie, Nimenrix peut également être coadministré avec les vaccins combinés dipthérie-tétanos-coqueluche acellulaire (DTCa), incluant les vaccins combinés DTCa avec l’hépatite B, la poliomyélite inactivée ou Haemophilus influenzae de type b (HepB, P ou Hib), tel que le vaccin DTCaP-HepB/Hib et le vaccin pneumococcique conjugué 13-valent.
Chez les personnes âgées de 9 à 25 ans, Nimenrix peut être coadministré avec le vaccin bivalent contre le papillomavirus humain [types 16 et 18], recombinant (HPV2).
Quand cela est possible, Nimenrix et un vaccin contenant de la TT, tel que le vaccin DTCaPHepB/ Hib, doivent être coadministrés ou Nimenrix doit être administré au moins un mois avant le vaccin contenant la TT.
Un mois après la coadministration avec un vaccin pneumococcique conjugué 10-valent, des Moyennes Géométriques des Concentrations en anticorps (MGC) et des MGT OPA (activité fonctionnelle opsonisante) plus faibles ont été observées pour un sérotype pneumococcique (18C conjugué à l’anatoxine tétanique en tant que protéine vectrice). La pertinence clinique de cette observation est inconnue. Il n’y a eu aucun impact de la coadministration sur les réponses immunitaires pour les neuf autres sérotypes pneumococciques.
Un mois après la coadministration avec un vaccin combiné adsorbé contenant l’anatoxine tétanique, une dose réduite d’anatoxine diphtérique et la valence anticoquelucheuse acellulaire (dTCa) chez des sujets âgés de 9 à 25 ans, des MGC plus faibles ont été observées pour chaque antigène coquelucheux (anatoxine coquelucheuse [AC], hémagglutinine filamenteuse [FHA] et pertactine [PRN]). Plus de
98 % des sujets présentaient des concentrations anti-AC, anti-FHA ou anti-PRN supérieures aux seuils limites des tests. La pertinence clinique de ces observations était inconnue. La coadministration n’a eu aucun impact sur la réponse immunitaire de Nimenrix ou sur les antigènes tétaniques ou diphtériques du vaccin dTCa.
Si Nimenrix doit être coadministré avec un autre vaccin injectable, les vaccins doivent toujours être administrés en des sites d’injection différents.
Il est possible qu’une réponse adéquate ne soit pas obtenue chez les patients recevant un traitement immunosuppresseur.
Fertilité
Les études effectuées chez l’animal n’ont pas mis en évidence d'effets délétères directs ou indirects sur la fécondité.
Grossesse
L’expérience d'utilisation de Nimenrix chez la femme enceinte est limitée.
Les études effectuées chez l’animal n’ont pas mis en évidence d'effets délétères directs ou indirects sur la gestation, le développement embryonnaire/fœtal, la parturition ou le développement post-natal (voir la rubrique "Autres informations", sous-rubrique "Données de sécurité préclinique").
Nimenrix doit être utilisé durant la grossesse seulement quand cela est clairement nécessaire, et que les avantages possibles l’emportent sur les risques potentiels pour le fœtus.
Allaitement
On ne sait pas si Nimenrix est excrété dans le lait maternel.
Nimenrix doit être utilisé durant l’allaitement seulement si les avantages possibles l’emportent sur les risques potentiels.
Effets indésirables
1. Résumé des effets indésirables
1.1. Résumé du profil de tolérance
La tolérance de Nimenrix présentée ci-dessous repose sur deux ensembles de données issus d’études cliniques comme suit :
- une analyse combinée de données provenant de 9 621 sujets ayant reçu une dose unique de Nimenrix. Ce total incluait 3 079 enfants en bas-âge (12 mois à 23 mois), 909 enfants âgés de 2 à 5 ans, 990 enfants âgés de 6 à 10 ans, 2 317 adolescents (11 à 17 ans) et 2 326 adultes (de 18 à 55 ans) ;
- des données issues d’une étude menée chez des nourrissons âgés de 6 à 12 semaines au moment de l’administration de la première dose (étude MenACWY-TT-083), au cours de laquelle 1 052 sujets ont reçu au moins une dose d’une première série de 2 ou 3 doses de Nimenrix et 1 008 sujets ont reçu une dose de rappel environ à l’âge de 12 mois.
Des données de sécurité ont également été évaluées dans une étude distincte, au cours de laquelle une dose unique de Nimenrix a été administrée à 274 sujets âgés de 56 ans et plus.
Effets indésirables locaux et généraux
Dans les tranches d’âges 6-12 semaines et 12-14 mois, après l’administration de 2 doses de Nimenrix à 2 mois d’intervalle, les première et seconde doses ont été associées à une réactogénicité locale et systémique similaire.
Le profil des effets indésirables locaux et généraux d’une dose de rappel de Nimenrix administrée à des sujets âgés de 12 mois à 30 ans après une primovaccination avec Nimenrix ou d’autres vaccins méningococciques polyosidiques conjugués ou non conjugués était similaire au profil des effets indésirables locaux et généraux observé après une primovaccination avec Nimenrix, à l’exception de symptômes gastro-intestinaux (incluant diarrhées, vomissements et nausées), qui étaient très fréquents chez les sujets âgés de 6 ans et plus.
1.2. Liste des effets indésirables
Les effets indésirables rapportés sont listés selon les catégories de fréquence suivantes :
- très fréquent : (≥ 1/10) ;
- fréquent : (≥ 1/100 à < 1/10);
- peu fréquent : (≥ 1/1000 à < 1/100);
- rare : (≥ 1/10 000 à < 1 /1000);
- très rare : (< 1/10 000) ;
- fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Les effets indésirables rapportés au cours des études menées chez les sujets âgés de 6 semaines à 55 ans et lors de l’expérience post-commercialisation sont présentés ci-dessous. Les effets indésirables rapportés chez les sujets âgés de plus de 55 ans ont été similaires à ceux observés chez les adultes plus jeunes.
Récapitulatif des effets indésirables par classe de systèmes d'organes
Troubles sanguins et du système lymphatique
- Fréquence indéterminée 3 : lymphadénopathie.
Affections du système immunitaire
- Peu fréquent : hypersensibilité 3.
- Fréquence indéterminée : anaphylaxie 3.
Troubles du métabolisme et de la nutrition
- Très fréquent : perte d’appétit.
Affections psychiatriques
- Très fréquent : irritabilité.
- Peu fréquent : insomnie, pleurs.
Affections du système nerveux
- Très fréquent : somnolence, céphalées.
- Peu fréquent : hypoesthésie, sensations vertigineuses.
- Rare : convulsions fébriles.
Affections gastro-intestinales
- Fréquent : diarrhées, vomissements et nausées 1.
Affections de la peau et du tissu sous-cutané
- Peu fréquent : prurit, urticaire, éruption cutanée 2.
Affections musculo-squelettiques et systémiques
- Peu fréquent : myalgies, douleur aux extrémités.
Troubles généraux et anomalies au site d'administration
- Très fréquent : fièvre, gonflement au site d'injection, douleur au site d'injection et rougeur au site d’injection, fatigue.
- Fréquent : hématome au site d’injection 1.
- Peu fréquent : malaise, induration au site d’injection, prurit au site d'injection, chaleurau site d'injection, anesthésieau site d'injection.
- Fréquence indéterminée 3 : oedème étendu du membre au site d’injection, fréquemment associé à un érythème, impliquant parfois l’articulation adjacente ou un oedème du membre entier vacciné.
2 l’effet indésirable « éruption cutanée » est survenu à la fréquence définie comme « fréquent » chez les nourrissons ;
3 EI identifié lors de l’expérience post-commercialisation.
2. Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Aucune étude n’a été effectuée sur les effets de Nimenrix sur la capacité à conduire des véhicules et à utiliser des machines.
Cependant, certains effets mentionnés dans la rubrique 4.8 “Effets indésirables” peuvent affecter la capacité à conduire des véhicules et à utiliser des machines.
3. Surdosage
Aucun cas de surdosage n’a été rapporté.
4. Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet :www.signalement-sante.gouv.fr.
Pharmacodynamie
Classe pharmacothérapeutique : Vaccins antiméningococciques
Code ATC : J07AH08.
1. Mécanisme d’action
Les anticorps anti-capsulaires contre les méningocoques protègent contre la maladie méningococcique via leur activité bactéricide médiée par le complément. Nimenrix induit la production d’anticorps bactéricides contre les polyosides capsulaires de Neisseria meningitidis des groupes A, C, W135 et Y, mesurés par des tests d’activité sérique bactéricide utilisant du rSBA ou du hSBA.
2. Immunogénicité chez les nourrissons
Au cours de l’étude MenACWY-TT-083, la première dose a été administrée à l’âge de 6 à 12 semaines, la deuxième après un intervalle de 2 mois, et une troisième dose (de rappel) administrée à l’âge de 12 mois environ. Un vaccin DTCaP-HepB/Hib et un vaccin pneumococcique conjugué 10-valent ont été coadministrés. Nimenrix a induit des titres rSBA et hSBA contre les quatre groupes de méningocoques comme indiqué dans le Tableau 1. La réponse contre le groupe C était non inférieure à celle induite par les vaccins enregistrés MenC-CRM et MenC-TT en termes de pourcentages avec des titres rSBA ≥ 8 à 1 mois après l’administration de la seconde dose.
Les données issues de cette étude étayent l'extrapolation des données d'immunogénicité et de posologie aux nourrissons âgés de 12 semaines à moins de 6 mois.
Tableau 1 : titres rSBA et hSBA suite à l’administration de deux doses de Nimenrix (ou MenC-CRM ou MenC-TT) à 2 mois d’intervalle, la première dose étant administrée à des nourrissons âgés de 6 à 12 semaines et suivi d’un rappel à 12 mois (étude MenACWY- TT-083)
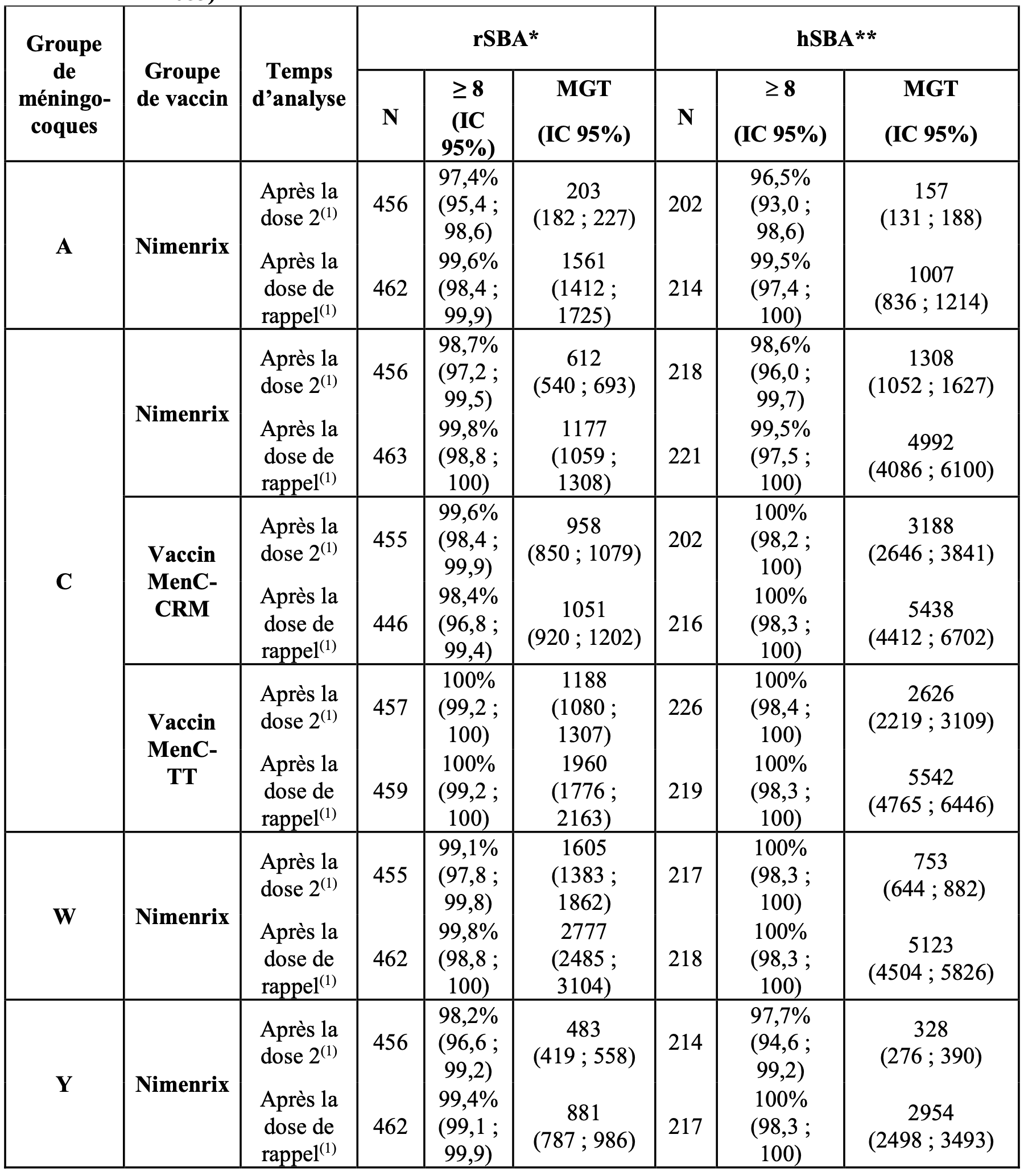

** Analyse hSBA effectuée par les laboratoires GSK ;
1 Echantillon de sang prélevé entre 21 et 48 jours post vaccination.
Au cours de l'étude MenACWY-TT-087, les nourrissons ont reçu soit une dose unique de primovaccination à 6 mois suivie d'une dose de rappel entre 12 et 18 mois (le vaccin DTCaP-Hib et le vaccin pneumococcique conjugué 10-valent étaient co-administrés au moment des deux vaccinations) soit trois doses de primo vaccination à 2, 4 et 6 mois suivies d'une dose de rappel entre 15 et 18 mois. La dose unique de primovaccination administrée à 6 mois a induit des titres rSBA élevés pour les quatre groupes de méningocoques, mesurés par le pourcentage des sujets ayant des titres rSBA> ou égal à 8, qui étaient comparables aux réponses observées après la dernière dose du schéma de primovaccination à 3 doses. Une dose de rappel a induit une forte réponse contre les quatre groupes de méningocoques, qui était comparable entre les deux schémas de primovaccination. Les résultats sont présentés dans le tableau 2.
Tableau 2 : titres rSBA et hSBA suite à l’administration d’une dose unique de Nimenrix chez les nourrissons à 6 mois et avant et après un rappel à 15-18 mois (étude MenACWY-TT- 087)

** Analyse hSBA effectuée à Neomed au Canada ;
1 Echantillon de sang prélevé 1 mois post vaccination.
La mesure des titres hSBA était un critère secondaire dans l’étude MenACWY-TT-087. Bien que des réponses similaires aient été observées pour les groupes A et C avec les deux schémas de vaccination, une dose unique de primovaccination chez les nourrissons âgés de 6 mois a été associée à des titres hSBA plus faibles pour les groupes W-135 et Y, mesurées par le pourcentage des patients dont les titres hSBA étaient ≥ 8 [87,2 % (IC 95 % : 74,3, 95,2) et 92,3 % (IC 95 % : 81,5, 97,9), respectivement] comparativement aux 3 doses de primovaccination administrées à 2, 4 et 6 mois [100 % (IC 95 % : 96,6, 100) et 100 % (IC 95 % : 97,1, 100), respectivement] (voir rubrique "Mises en garde et précautions d'emploi"). Après une dose de rappel, les titres hSBA pour les quatre groupes de méningocoques étaient comparables entre les deux schémas vaccinaux. Les résultats sont présentés dans le Tableau 2.
3. Immunogénicité chez les enfants en bas-âge âgés de 12 à 23 mois
Dans les études cliniques MenACWY-TT-039 et MenACWY-TT-040, une dose unique de Nimenrix a induit des titres SBA contre les 4 groupes de méningocoques, avec des titres rSBA du groupe C comparables à ceux induits par un vaccin enregistré MenC-CRM en termes de pourcentage de sujets avec des titres rSBA ≥ 8. Au cours de l’étude MenACWY-TT-039, les hSBA ont également été mesurés en critère secondaire. Les résultats sont présentés dans le Tableau 3.
Tableau 3 : titres SBA * suite à une dose unique de Nimenrix (ou MenC-CRM) chez les enfants en bas-âge âgés de 12 à 23 mois (études MenACWY-TT-039/040)

2 Echantillon de sang prélevé entre 30 et 42 jours post vaccination ;
* Analyses SBA effectuées par les laboratoires GSK.
4. Immunogénicité à long terme chez les enfants en bas-âge
L’étude MenACWY-TT-104 a évalué l’immunogénicité après 1 mois et la persistance de la réponse jusqu’à 5 ans après 1 ou 2 doses (administrées à 2 mois d’intervalle) de Nimenrix chez des enfants en bas-âge âgés de 12 à 14 mois. Un mois après l’administration d’une ou de deux doses, Nimenrix a induit des titres rSBA contre les quatre groupes de méningocoques qui étaient similaires en termes de pourcentage de sujets avec un titre rSBA ≥ 8 et de MGT. Comme critère secondaire, les titres rSBA ont été mesurés. Un mois après l’administration d’une ou deux doses, Nimenrix a induit des titres hSBA contre les groupes W-135 et Y qui étaient supérieurs en termes de pourcentage de sujets avec un titre hSBA ≥ 8 après l’administration de deux doses, comparativement à une dose (voir rubrique "Mises en garde et précautions d'emploi"). Nimenrix a induit des titres hSBA contre les groupes A et C qui étaient similaires en termes de pourcentage de sujets avec un titre hSBA ≥ 8 après l’administration de deux doses, comparativement à une dose. À l’année 5, seule une petite différence dans la persistance des anticorps entre une et deux doses a été observée, en termes de pourcentages de sujets avec des titres hSBA ≥ 8 contre tous les groupes. La persistance des anticorps a été observée à l’année 5 contre les groupes C, W-135 et Y. Après une et deux doses, les pourcentages de sujets avec des titres hSBA ≥ 8 étaient de 60,7 % et 67,8 % pour le groupe C, de 58,9 % et 63,6 % pour le groupe W-135 et de 61,5 % et 54,2 % pour le groupe Y, respectivement. Pour le groupe A, 27,9 % et 17,9 % des sujets recevant une ou deux doses, respectivement, présentaient des titres hSBA ≥ 8. Les résultats sont présentés dans le Tableau 4.
Tableau 4 : titres rSBA et hSBA suite à l’administration d’une ou deux doses de Nimenrix avec la première dose administrée chez les enfants en bas-âge âgés de 12 à 14 mois et persistance jusqu’à 5 ans (étude MenACWY-TT-104)

1 Echantillon de sang prélevé entre 21 et 48 jours post vaccination ;
* Analyse rSBA effectuée par les laboratoires PHE ;
** Analyse hSBA effectuée par les laboratoires GSK.
Les titres rSBA et hSBA ont été déterminés sur une période de 10 ans chez les enfants primovaccinés avec une dose de Nimenrix ou de MenC-CRM à l’âge de 12 à 23 mois dans l’étude MenACWY-TT- 027. La persistance des titres SBA a été évaluée au cours de deux études d’extension : MenACWY- TT-032 (jusqu’à 5 ans) et MenACWY-TT-100 (jusqu’à 10 ans). L’étude MenACWY-TT-100 a également évalué la réponse à une dose de rappel unique de Nimenrix administrée 10 ans après la primovaccination avec Nimenrix ou MenC-CRM. Les résultats sont présentés dans le Tableau 5 (voir rubrique "Mises en garde et précautions d'emploi").
Tableau 5 : titres rSBA et hSBA suite à l’administration d’une dose unique de Nimenrix (ou MenC-CRM) chez les enfants en bas-âge âgés de 12 à 23 mois, persistance jusqu’à 10 ans après la vaccination, et après le rappel administré 10 ans après la primovaccination (études MenACWY-TT-027/032/100)

2 : Étude MenACWY-TT-032 ;
3 : Étude MenACWY-TT-100 ;
4 : L’échantillon de sang a été prélevé 1 mois après une dose de rappel à l’Année 10 ;
* Analyse rSBA effectuée par les laboratoires GSK pour les échantillons prélevés un mois après la primovaccination et par les laboratoires PHE au Royaume-Uni pour les prélèvements ultérieurs ;
** Analyse hBSA effectuée par les laboratoires GSK et par Neomed au Canada pour chaque temps d’analyse de l’étude MenACWY-TT-100.
5. Persistance de la réponse de rappel
L’étude MenACWY-TT-102 a évalué la persistance des titres de SBA jusqu’à 6 ans après une dose de rappel de Nimenrix ou MenC-CRM197 administrée dans l’étude MenACWY-TT-048 à des enfants ayant reçu initialement le même vaccin à l’âge de 12 à 23 mois dans l’étude MenACWY-TT-039. Une dose de rappel unique a été administrée 4 ans après la vaccination initiale. Les résultats sont présentés dans le tableau 6 (voir rubrique "Mises en garde et précautions d'emploi").
Tableau 6 : titres rSBA et hSBA après une dose unique de Nimenrix (ou MenC-CRM) chez les nourrissons âgés de 12 à 23 mois, persistance à 4 ans et réponse après un rappel 4 ans après la vaccination initiale et persistance jusqu’à 6 ans après la vaccination de rappel (études MenACWY-TT-039/048/102)
2 Etude MenACWY-TT-048 ;
3 Un prélèvement sanguin a été effectué 1 mois après une dose de rappel à l’année 4 ;
4 Etude MenACWY-TT-102 ;
* Test rSBA effectué par les laboratoires GSK 1 mois après la primovaccination et par les laboratoires PHE au Royaume-Uni pour les prélèvements ultérieurs ;
**Test hSBA effectué par les laboratoires GSK et par Neomed au Canada pour chaque temps d’analyse de l’étude MenACWY-TT-102.
6. Immunogénicité chez les enfants âgés de 2 à 10 ans
Dans l’étude MenACWY-TT-081, la non-infériorité d’une dose unique de Nimenrix par rapport à un autre vaccin enregistré MenC-CRM a été démontrée en termes de réponse vaccinale pour le groupe C [94,8% (IC 95% : 91,4 ; 97,1) et 95,7% (IC 95% : 89,2 ; 98,8), respectivement]. Les MGT ont été inférieures dans le groupe Nimenrix [2795 (IC 95% : 2393 ; 3263)] versus le vaccin MenC-CRM [5292 (IC 95% : 3815 ; 7340)].
Dans l’étude MenACWY-TT-038, la non-infériorité d’une dose unique de Nimenrix par rapport au vaccin enregistré ACWY-PS a été démontrée en termes de réponse vaccinale pour les 4 groupes de méningocoques, comme présenté dans le Tableau 7.
Tableau 7 : titres rSBA * suite à une dose unique de Nimenrix (ou ACWY-PS) chez les enfants âgés de 2 à 10 ans (étude MenACWY-TT-038)

RV = réponse vaccinale définie comme le pourcentage de sujets avec :
- des titres rSBA ≥32 pour les sujets initialement séronégatifs (i.e. titre rSBA pré-vaccinal < 8) ;
- une multiplication au moins par 4 des titres rSBA entre les périodes pré- et post-vaccinale pour les sujets initialement séropositifs (i.e. titre rSBA pré-vaccinal ≥ 8).
La persistance des titres SBA a été évaluée chez les enfants primovaccinés dans l’étude MenACWY- TT-081 comme présenté dans le Tableau 8 (voir rubrique "Mises en garde et précautions d'emploi").
Tableau 8 : titres rSBA et hSBA jusqu’à 44 mois suivant l’administration de Nimenrix (ou MenC-CRM) chez des enfants âgés de 2 à 10 ans au moment de la vaccination (étude MenACWY-TT-088)

** Analyse hSBA effectuée par les laboratoires GSK.
La persistance des titres hSBA a été évaluée 1 an après la vaccination chez des enfants âgés de 6 à 10 ans primovaccinés dans l’étude MenACWY-TT-027 (Tableau 9).
Tableau 9 : titres hSBA * suite à l’administration d’une dose unique de Nimenrix (ou ACWY- PS) chez les enfants âgés de 6 à 10 ans et persistance à 1 an après la vaccination (études MenACWY-TT-027/028)

1 A 1 an après la vaccination. L’analyse hSBA n’a pas été effectuée chez les enfants < 6 ans (au moment de la vaccination) ;
* Analyse hSBA effectuée par les laboratoires GSK.
Les titres SBA ont été déterminés sur une période de 10 ans chez les enfants vaccinés
avec une dose de Nimenrix ou ACWY-PS à l’âge de 2 à 10 ans dans l’étude MenACWY-TT-027. La persistance des titres SBA a été évaluée au cours de deux études d’extension : MenACWY-TT-032 (jusqu’à 5 ans) et MenACWY-TT-100 (jusqu’à 10 ans). L’étude MenACWY-TT-100 a également évalué la réponse à une dose de rappel unique de Nimenrix administrée 10 ans après la primovaccination avec Nimenrix ou ACWY-PS. Les résultats sont présentés dans le Tableau 10(voir rubrique "Mises en garde et précautions d'emploi").
Tableau 10 : titres rSBA et hSBA suite à l’administration d’une dose unique de Nimenrix (ou ACWY-PS) chez les enfants âgés de 2 à 10 ans, persistance jusqu’à 10 ans, et après le rappel administré 10 ans après la vaccination initiale (études MenACWY-TT-027/032/100)

2 Etude MenACWY-TT-032 ;
3 Etude MenACWY-TT-100 ;
4 L’échantillon de sang a été prélevé 1 mois après une dose de rappel à l’Année 10 ;
5 Inclut les enfants âgés de 6 à < 11 ans. L’analyse hSBA n’a pas été effectuée chez les enfants âgés de 2 à < 6 ans (au moment de la vaccination) ;
6 Selon le protocole de l’étude MenACWY-TT-032, les titres hSBA n’ont pas été mesurés chez ce groupe d’âge à l’Année 5.
** Analyse hBSA effectuée par les laboratoires GSK et Neomed au Canada pour chaque temps d’analyse de l’étude MenACWY-TT-100.
7. Immunogénicité chez les adolescents âgés de 11 à 17 ans et les adultes ≥ 18 ans
Dans 2 études cliniques réalisés chez des adolescents âgés de 11 à 17 ans (étude MenACWY-TT-036) et des adultes âgés de 18 à 55 ans (étude MenACWY-TT-035), une dose de Nimenrix ou une dose de vaccin ACWY-PS a été administrée.
La non-infériorité immunologique de Nimenrix par rapport au vaccin ACWY-PS a été démontrée en termes de réponse vaccinale (présentée dans le Tableau 11).
Tableau 11 : titres rSBA * suite à l’administration d’une dose unique de Nimenrix (ou ACWY- PS) chez les adolescents âgés de 11 à 17 ans et les adultes âgés de 18 à 55 ans (études MenACWY-TT-035/036)

1 Echantillon de sang prélevé 1 mois post vaccination ;
RV = réponse vaccinale définie comme le pourcentage de sujets avec :
- des titres rSBA ≥ 32 pour les sujets initialement séronégatifs (c.-à-d. titre rSBA pré-vaccinal < 8) ;
- une multiplication au moins par 4 des titres rSBA entre les périodes pré- et post-vaccinale pour les sujets initialement séropositifs (c.-à-d. titre rSBA pré-vaccinal ≥ 8).
Les titres rSBA ont été déterminés sur une période de 10 ans chez les sujets vaccinés initialement avec une dose de Nimenrix ou ACWY-PS à l’âge de 11 à 17 ans dans l’étude MenACWY-TT-036. La persistance des titres rSBA a été évaluée au cours de deux études d’extension : MenACWY-TT-043 (jusqu’à 5 ans) et MenACWY-TT-101 (à 10 ans). L’étude MenACWY-TT-101 a également évalué la réponse à une dose de rappel unique de Nimenrix administrée 10 ans après la primovaccination avec Nimenrix ou ACWY-PS. Les résultats sont présentés dans le Tableau 12.
Tableau 12 : titres rSBA * suite à l’administration d’une dose unique de Nimenrix (ou ACWY- PS) chez les adolescents âgés de 11 à 17 ans, persistance jusqu’à 10 ans, et après le rappel administré 10 ans après la primovaccination (études MenACWY-TT- 036/043/101)

2 Etude MenACWY-TT-043 ;
3 Etude MenACWY-TT-101 ;
4 L’échantillon de sang a été prélevé 1 mois après une dose de rappel à l’Année 10.
La persistance du titre hSBA a été évaluée jusqu’à 5 ans après la vaccination chez des adolescents et des adultes vaccinés initialement dans l’étude MenACWY-TT-052, présentée dans le Tableau 13.
Tableau 13 : titres hSBA * suite à l’administration d’une dose unique de Nimenrix chez des adolescents et des adultes âgés de 11 à 25 ans et persistance jusqu’à 5 ans après la vaccination (études MenACWY-TT-052/059)

2 Etude MenACWY-TT-059 ;
* Analyse hSBA effectuée par les laboratoires GSK.
Les titres rSBA ont été déterminés sur une période de 10 ans chez les sujets vaccinés initialement avec une dose de Nimenrix ou ACWY-PS à l’âge de 11 à 55 ans dans l’étude MenACWY-TT-015. La persistance des titres rSBA a été évaluée au cours de deux études d’extension : MenACWY-TT-020 (jusqu’à 5 ans) et MenACWY-TT-099 (jusqu’à 10 ans). L’étude MenACWY-TT-099 a également évalué la réponse à une dose de rappel unique de Nimenrix administrée 10 ans après la primovaccination avec Nimenrix ou ACWY-PS. Les résultats sont présentés dans le Tableau 14.
Tableau 14 : titres rSBA * suite à l’administration d’une dose unique de Nimenrix (ou ACWY- PS) chez les adolescents et les adultes âgés de 11 à 55 ans, persistance jusqu’à 10 ans, et après le rappel administré 10 ans après la primovaccination (études MenACWY-TT-015/020/099)
1 Étude MenACWY-TT-015.
2 Étude MenACWY-TT-020.
3 Étude MenACWY-TT-099.
4 L’échantillon de sang a été prélevé 1 mois après une dose de rappel à l’Année 10.
* Analyse rSBA effectuée par les laboratoires GSK pour les échantillons prélevés un mois après la primovaccination et par les laboratoires PHE au Royaume-Uni pour les prélèvements ultérieurs.
Dans une étude séparée (MenACWY-TT-085), une dose unique de Nimenrix a été administrée à194 adultes libanais âgés de 56 ans et plus (incluant 133 sujets âgés de 56 à 65 ans et 61 sujets âgés de plus 65 ans). Le pourcentage de sujets avec des titres rSBA (mesurés dans les laboratoires GSK) ≥ 128 avant vaccination allait de 45% (groupe C) à 62% (groupe Y). Globalement, 1 mois après la vaccination, le pourcentage de sujets vaccinés avec des titres rSBA ≥ 128 allait de 93% (groupe C) à 97% (groupe Y). Dans le sous-groupe des sujets âgés de plus de 65 ans, le pourcentage de sujets vaccinés avec des titres rSBA ≥ 128, 1 mois après la vaccination, allait de 90% (groupe A) à 97% (groupe Y).
8. Réponse à la dose de rappel chez les sujets ayant antérieurement reçu un vaccin polyosidique conjugué contre Neisseria meningitidis
L’administration d’une dose de rappel de Nimenrix chez les sujets primovaccinés avec un vaccin monovalent (MenC-CRM) ou un vaccin quadrivalent méningococcique conjugué (MenACWY-TT) a été étudiée chez les sujets à partir de l’âge de 12 mois ayant reçu une dose de rappel. Des réponses anamnestiques robustes aux antigènes ont été observées lors de la primovaccination (voir les Tableaux 5, 6, 10, 12 et 14).
9. Réponse à Nimenrix chez les sujets ayant antérieurement reçu un vaccin polyosidique non conjugué contre Neisseria meningitidis
Dans l’étude MenACWY-TT-021 réalisé chez des sujets âgés de 4,5 à 34 ans, l’immunogénicité de Nimenrix administré entre 30 et 42 mois après une vaccination par le vaccin ACWY-PS a été comparée à celle de Nimenrix administré à des sujets appariés à l’âge et n’ayant pas reçu de vaccin méningococcique durant les 10 années précédentes. Une réponse immunitaire (titre rSBA ≥8) a été observée contre l’ensemble des quatre groupes de méningocoques chez tous les sujets quel que soit leur antécédent de vaccination méningococcique. Les MGT rSBA ont été significativement plus faibles chez les sujets ayant reçu une dose du vaccin ACWY-PS 30 à 42 mois avant Nimenrix, cependant, 100% des sujets ont atteint des titres rSBA ? 8 pour les 4 groupes de méningocoques (A, C, W-135, Y) (voir la rubrique "Mises en garde et précautions d'emploi").
10. Enfants (2 à 17 ans) présentant une asplénie anatomique ou fonctionnelle
L’étude MenACWY-TT-084 a comparé la réponse immunitaire à 2 doses de Nimenrix administrées à deux mois d’intervalle chez 43 sujets âgés de 2 à 17 ans présentant une asplénie anatomique ou fonctionnelle et chez 43 sujets du même âge ayant une fonction splénique normale. Un mois après la première dose du vaccin et 1 mois après la seconde dose du vaccin, une proportion équivalente de sujets des deux groupes a atteint des titres rSBA ≥ 8 et ≥ 128 et des titres hSBA ≥ 4 et ≥ 8.
11. Immunogénicité après deux doses de Nimenrix à l’âge de 3 et 12 mois
Au cours de l’étude C0921062, les nourrissons ont reçu une dose unique de primovaccination à l’âge de 3 mois suivie d’une dose de rappel à l’âge de 12 mois. La dose unique de primovaccination administrée à l’âge de 3 mois a induit des titres rSBA élevés pour les quatre groupes de méningocoques, mesurés par le pourcentage des sujets ayant des titres rSBA ≥ 8 et des MGT. Une dose de rappel a induit une forte réponse contre les quatre groupes de méningocoques. Les résultats sont présentés dans le Tableau 15.
Tableau 15 : Titres rSBA entre les périodes pré- et post-vaccinales avec deux doses à l’âge de 3 et 12 mois (étude C0921062).
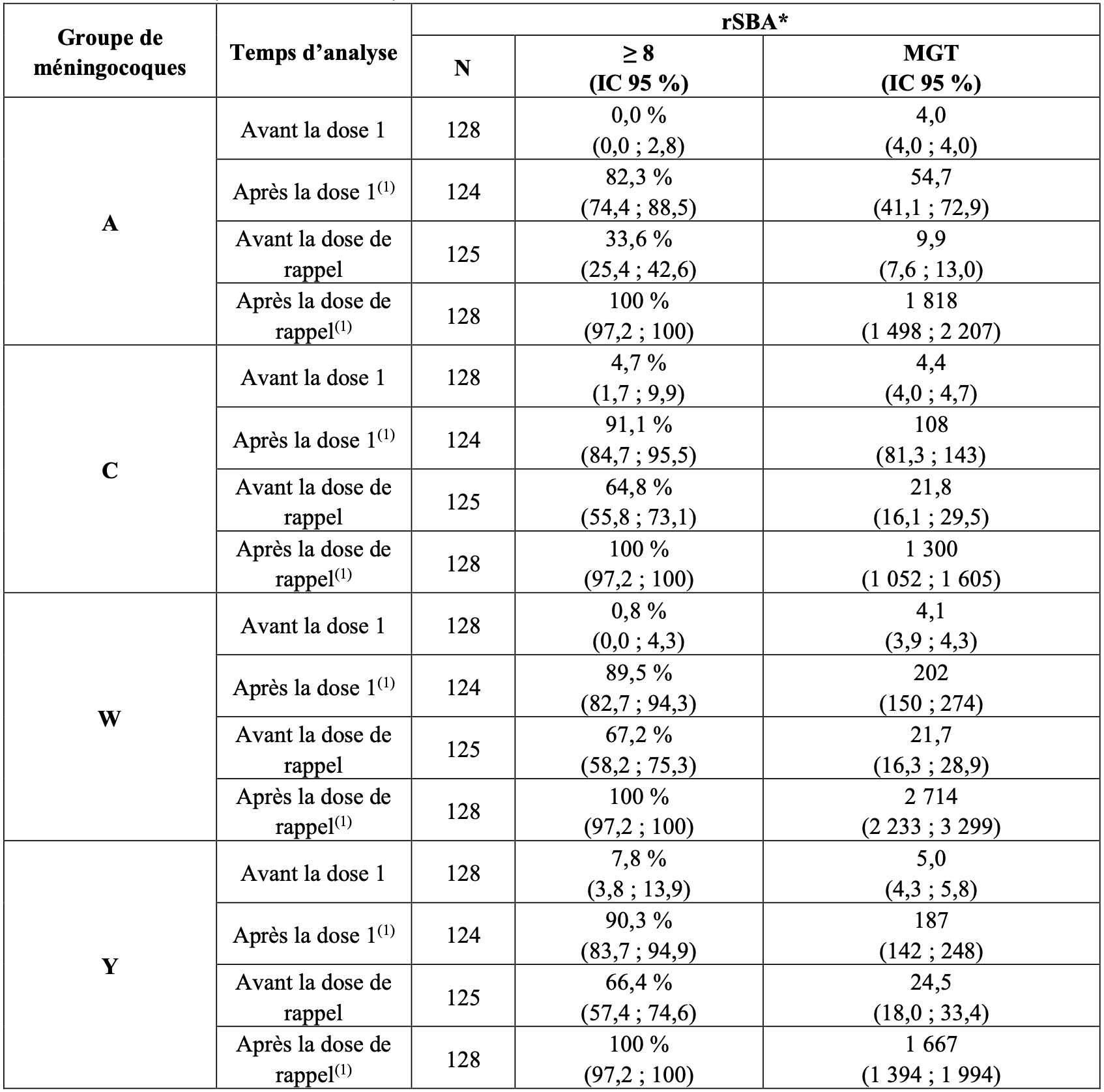
(1) échantillon de sang prélevé 1 mois post-vaccination
Les données hSBA comme critère secondaire ne sont pas incluses dans le tableau en raison des données limitées.
12. Impact d’une dose unique de Nimenrix
En 2018, les Pays-Bas ont ajouté Nimenrix au programme national de vaccination avec une dose unique chez les jeunes enfants âgés de 14 mois afin de remplacer le vaccin méningococcique conjugué du groupe C. Une campagne de rattrapage avec une dose unique de Nimenrix chez les adolescents âgés de 14 à 18 ans a également été lancée en 2018, et est devenue systématique en 2020, ce qui a conduit à un programme national de vaccination des enfants en bas âge et des adolescents. En deux ans, l’incidence de la maladie méningococcique due aux groupes C, W et Y a été réduite de manière significative de 100 % (IC à 95 % : 14, 100) chez les personnes âgées de 14 à 18 ans, de 85 % (IC à 95 % : 32, 97) dans tous les âges admissibles au vaccin (effet direct) et de 50 % (IC à 95 % : 28, 65) dans les âges non admissibles au vaccin (effet indirect). L’impact de Nimenrix a été principalement dû à une réduction de la maladie du groupe W.
Conservation
Durée de conservation : 4 ans.
Le flacon non ouvert est stable pendant 72 heures lorsqu’il est conservé à des températures comprises entre 0 °C et 2 °C ou entre 8 °C et 25 °C. À la fin de cette période, Nimenrix doit être utilisé ou jeté.
Ces données sont destinées à guider les professionnels de santé en cas de variations temporaires de température uniquement.
A conserver au réfrigérateur: entre 2°Cet 8 °C.
Ne pas congeler.
A conserver dans l'emballage extérieur d'origine, à l'abri de la lumière.
Après reconstitution
Après reconstitution, le vaccin doit être utilisé rapidement. Bien qu'il ne soit pas recommandé d'attendre, la stabilité a été démontrée pendant 8 heures à 30 °C après reconstitution. Si le vaccin n'est pas utilisé dans les 8 heures, ne pas l'administrer.
Manipulation
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments.
Instructions pour la reconstitution du vaccin avec le solvant présenté en seringue préremplie
Nimenrix doit être reconstitué en ajoutant la totalité du contenu de la seringue préremplie de solvant dans le flacon contenant la poudre.
Pour fixer l’aiguille à la seringue, se référer à l’illustration ci-dessous. Cependant, la seringue fournie avec Nimenrix peut être légèrement différente (sans le pas de vis) de la seringue décrite dans l’illustration. Dans ce cas, l’aiguille peut être fixée sans visser.
1 - En tenant le corps de la seringue d’une main (en évitant de tenir le piston), dévisser l’embout protecteur de la seringue en le tournant dans le sens inverse des aiguilles d’une montre.
2 - Pour fixer l’aiguille sur la seringue, visser l’aiguille dans le sens des aiguilles d’une montre sur la seringue jusqu’à sentir un blocage (voir l’illustration).
3 - Enlever le protège aiguille, ce qui peut être parfois un peu difficile.
4 - Ajouter le solvant à la poudre. Après l’ajout du solvant à la poudre, le mélange doit être bien agité jusqu’à ce que la poudre soit complètement dissoute dans le solvant.
Le vaccin reconstitué est une solution transparente et incolore.
Le vaccin reconstitué doit être inspecté visuellement pour vérifier l’absence de toute particule étrangère et/ou tout changement de son aspect physique, avant administration. Dans l'un ou l'autre de ces cas, jeter le vaccin.
Après reconstitution, le vaccin doit être utilisé rapidement.
Une nouvelle aiguille doit être utilisée pour administrer le vaccin.
L'administration du vaccin doit être consignée par le médecin sur le carnet de vaccination ou de santé avec le numéro de lot. Il peut aussi être inscrit par le patient ou son médecin sur un carnet de vaccination numérique (version grand public ou professionnelle).
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Autres informations
Données de sécurité préclinique
Les données non cliniques issues des études conventionnelles de tolérance locale, de toxicité aiguë, toxicologie en administration répétée, et des fonctions de reproduction/ développement et de fécondité, n’ont pas révélé de risque particulier pour l’homme.
Remboursement
Remboursé par la Sécurité sociale à 65 % pour la seule indication « immunisation active des sujets à partir de 12 mois contre les maladies méningococciques invasives dues aux Neisseria meningitidis des sérogroupes A, C, W et Y, uniquement dans la population des sujets devant pouvoir bénéficier d'une protection durable et étendue vis-à-vis d'un nombre élargi de sérogroupes de méningocoque :
- sujets porteurs d'un déficit en fraction terminale du complément ou qui reçoivent un traitement anti-C5A ;
- sujets porteurs d'un déficit en properdine ou ayant une asplénie anatomique ou fonctionnelle ;
- sujets ayant reçu une greffe de cellules souches hématopoïétiques.
Cette présentation est agréée aux collectivités.
Arrêté du 18 février 2026 : remboursement du rattrapage vaccinal temporaire pour les enfants nés en 2020, 2021 ou 2022.