TRUMENBA
Laboratoire : Pfizer
Ce vaccin est maintenant remboursé à 65 % par l'assurance maladie depuis le 25 juillet 2025. Il peut être utilisé, comme le vaccin BEXSERO, pour appliquer la recommandation de vaccination des 15-24 ans. Il peut également être utilisé, comme c'était déjà le cas auparavant, pour vacciner les personnes à risque d'infection invasive à méningocoque B âgées de 10 ans et plus.
Vaccin commercialisé en France depuis le 21 septembre 2021. L'autorisation de mise sur le marché a été prononcée par l'Agence européenne des médicaments le 24 mai 2017.
Description
Vaccin contre les méningocoques du sérogroupe B (recombinant, adsorbé).
Forme et Présentation
Trumenba suspension injectable en seringue préremplie.
Suspension liquide blanche.
Nature et contenu de l'emballage extérieur
- 0,5 mL de suspension en seringue préremplie (verre de type I) munie d’un adaptateur Luer Lock en plastique, d’un bouchon-piston en caoutchouc chlorobutyle et d’un protège-embout en caoutchouc bromobutyle isoprène synthétique avec un capuchon de protection en plastique rigide, avec ou sans aiguille. Le protège-embout et le bouchon-piston de la seringue préremplie ne contiennent pas de latex de caoutchouc naturel.
Boîtes de 1, 5 et 10 seringues préremplies, avec ou sans aiguille.
Toutes les présentations peuvent ne pas être commercialisées.
Composition
Une dose (0,5 mL) contient :
1. Antigènes
- fHbp de la sous-famille A 1,2,3 de Neisseria meningitidis de sérogroupe B : 60 microgrammes
- fHbp de la sous-famille B 1,2,3 de Neisseria meningitidis de sérogroupe B : 60 microgrammes
2 Produite dans des cellules d’Escherichia coli par la technique de l’ADN recombinant ;
3 Adsorbée sur du phosphate d’aluminium (0,25 milligramme d’aluminium par dose).
2. Excipients
- Chlorure de sodium
- Histidine
- Polysorbate 80 (E433)
- Eau pour préparations injectables
Excipients à effet notoire
Trumenba contient 0,018 mg de polysorbate 80 par dose de 0,5 mL, ce qui équivaut à 0,035 mg/mL de polysorbate 80.
Indications
Trumenba est indiqué pour l’immunisation active des sujets à partir de l’âge de 10 ans pour la prévention contre les maladies invasives méningococciques causées par Neisseria meningitidis de sérogroupe B.
Voir rubrique "Pharmacodynamie" pour plus d’informations sur la réponse immunitaire contre les souches spécifiques de sérogroupe B.
Ce vaccin doit être utilisé conformément aux recommandations officielles.
Recommandations nationales
1. Recommandations générales
Vaccination des adolescents et jeunes adultes âgés de 15 à 24 ans. Cette recommandation est en vigueur depuis la publication de l'arrêté du 25 juillet 2025 qui déclare que le vaccin TRUMENBA est remboursé dans cette tranche d'âge. Cette recommandation est fondée sur ce communiqué du ministère de la santé du 24 avril 2025.
Il est indiqué dans le calendrier des vaccinations que la vaccination contre le méningocoque B peut être proposée chez les 15-24 ans. Le pharmacien, l'infirmière ou la sage-femme peuvent donc proposer (prescription et administration) le vaccin BEXSERO ou le vaccin TRUMENBA aux 15-24 ans.
2. Vaccination des personnes à risque
- personnels des laboratoires de recherche travaillant spécifiquement sur le méningocoque ;
- personnes porteuses d’un déficit en fraction terminale du complément ou qui reçoivent un traitement anti-C5 notamment les personnes qui reçoivent un traitement par eculizumab (SOLIRIS®) ou ravulizumab (ULTROMIRIS®). Les personnes vaccinées dans le cadre d’une affection médiée par le complément doivent faire l’objet d’une surveillance post vaccinale du fait de la survenue possible d’une hémolyse ;
- personnes porteuses d’un déficit en properdine ;
- personnes ayant une asplénie anatomique ou fonctionnelle ;
- personnes ayant reçu une greffe de cellules souches hématopoïétiques ;
- entourage familial des personnes à risque élevée d’infection invasive à méningocoque B.
Les enfants de plus de 2 ans, les adolescents et les adultes présentant un risque continu d’exposition à une infection méningococcique recevront une injection de rappel tous les 5 ans.
3. Vaccination dans le cadre de situations spécifiques
3.1. La vaccination par Trumenba est recommandée dans les deux situations suivantes
a) Grappe de cas définie par la survenue d’au moins 2 cas d'infection invasive à méningocoque B
- cas dans une même collectivité ou un même groupe social ;
- dans un délai ≤ à 4 semaines ;
- et survenus et rattachables à des souches identiques couvertes par le vaccin Trumenba ou ne pouvant être différenciées.
b) Situation épidémique
- définie par les critères d’alerte épidémique ;
- et liée à une souche couverte par le vaccin Trumenba.
3.2. La vaccination est envisagée par un groupe multidisciplinaire d'experts au niveau national ou local dans les situations suivantes
a) grappe de cas définies par la survenue d’au moins 2 cas d'infection invasive à méningocoque B
- cas dans une même collectivité ou un même groupe social ;
- dans un intervalle de temps > à 4 semaines et ≤ à 3 mois ;
- survenus et rattachables à des souches identiques couvertes par le vaccin Trumenba ou ne pouvant être différenciées.
b) situation d’hyperendémie, correspondant à l’installation progressive et potentiellement durable d’un clone dans une zone géographique, le plus souvent infra-départementale : des critères d’alerte ont été proposés par Santé publique France et ont fait l’objet d’une validation par la Direction générale de la santé, puis d’une intégration dans une version actualisée de l’instruction de la Direction générale de la santé.
Les personnes qui ont commencé un programme de vaccination avec Trumenba doivent le poursuivre avec Trumenba, les vaccins BEXSERO et TRUMENBA n’étant pas interchangeables. Dans le respect de leurs autorisations respectives, il n’y a pas d’éléments permettant de privilégier le vaccin Trumenba ou le vaccin BEXSERO dans le cadre des présentes recommandations.
Posologie
1. Schémas de primovaccination
- 2 doses (de 0,5 mL chacune) administrées à 6 mois d’intervalle (voir rubrique "Pharmacodynamie).
- 3 doses : 2 doses (de 0,5 mL chacune) administrées à au moins 1 mois d’intervalle, suivies d’une troisième dose administrée au moins 4 mois après la deuxième dose (voir rubrique "Pharmacodynamie).
2. Dose de rappel
- Une dose de rappel devrait être envisagée à la suite de chacun des deux schémas posologiques chez les sujets présentant un risque continu d'infection invasive à méningocoque (voir rubrique "Pharmacodynamie).
3. Autre population pédiatrique
La sécurité et l’efficacité de Trumenba n’ont pas été établies chez les enfants âgés de moins de 10 ans.
Les données actuellement disponibles chez les nourrissons sont décrites à la rubrique "Effets indésirables" et celles disponibles chez les enfants âgés de 1 à 9 ans sont décrites aux rubriques "Effets indésirables" et "Pharmacodynamie" ; cependant, aucune recommandation posologique ne peut être donnée car les données sont limitées.
Trumenba ne doit pas être utilisé chez les nourrissons âgés de 2 à 6 mois en raison de préoccupations liées à la sécurité (voir rubrique "Effets indésirables").
Mode d'administration
Par injection intramusculaire uniquement. Le site d’injection préférentiel est le muscle deltoïde de la partie supérieure du bras.
Pour les instructions concernant la manipulation du vaccin avant administration, voir la rubrique "Manipulation".
Aucune donnée n’est disponible concernant l’interchangeabilité de Trumenba avec d’autres vaccins méningococciques de sérogroupe B pour compléter le schéma vaccinal.
Contre-indications
Hypersensibilité aux substances actives ou à l’un des excipients (voir rubrique "Composition").
Mises en garde et précautions d'emploi
Traçabilité
Afin d’améliorer la traçabilité des médicaments biologiques, le nom commercial et le numéro de lot du médicament administré doivent être clairement enregistrés (ou mentionnés) dans le dossier du patient.
Hypersensibilité
Un traitement médical approprié et une surveillance adéquate doivent toujours être disponibles en cas de réaction anaphylactique consécutive à l’administration du vaccin.
Syncope
Comme avec d’autres vaccins injectables, une syncope (évanouissement) liée à l’administration de Trumenba peut survenir. Des procédures doivent être instaurées afin d’éviter d’éventuelles blessures lors de l’évanouissement.
Maladie aiguë concomitante
La vaccination doit être reportée chez des sujets souffrant d’une maladie fébrile sévère aiguë. Toutefois, la présence d’une infection mineure, telle qu’un rhume, ne doit pas entraîner le report de la vaccination.
Injections intramusculaires
Trumenba ne doit pas être administré par voie intraveineuse, intradermique ou sous-cutanée.
Trumenba ne doit pas être administré aux sujets présentant une thrombocytopénie ou tout autre trouble de la coagulation qui constituerait une contre-indication à une injection par voie intramusculaire, à moins que le bénéfice potentiel ne soit clairement supérieur aux risques inhérents à l’administration.
Immunocompétence altérée
Les sujets immunodéprimés, y compris les sujets traités par immunosuppresseurs, peuvent présenter une réponse immunitaire diminuée à Trumenba. Des données d’immunogénicité sont disponibles chez les personnes présentant un déficit en complément ou des dysfonctionnements de la rate (voir rubrique "Pharmacodynamie").
Les personnes présentant un déficit familial en complément (par exemple, C5 ou C3) et les personnes recevant des traitements inhibant l’activation terminale du complément (par exemple, l’éculizumab) ont un risque accru de maladie invasive due à Neisseria meningitidis de sérogroupe B, même si elles développent des anticorps après la vaccination avec Trumenba.
Protection contre les infections à méningocoque
Comme pour tout vaccin, la vaccination avec Trumenba peut ne pas protéger tous les sujets vaccinés.
Limites des essais cliniques
Les données concernant l’utilisation de Trumenba chez les sujets âgés de 40 à 65 ans sont limitées et il n’existe aucune donnée concernant l’utilisation de Trumenba chez les sujets de plus de 65 ans.
Excipients
Ce vaccin contient du polysorbate 80 (voir rubrique 2). Le polysorbate 80 peut provoquer des réactions d’hypersensibilité.
Ce vaccin contient moins de 1 mmol (23 mg) de sodium par dose. Les personnes suivant un régime hyposodé peuvent être informées que ce vaccin est essentiellement sans sodium.
Interactions
Trumenba peut être administré de manière concomitante avec les vaccins suivants : Vaccin combiné contenant l’anatoxine tétanique, une dose réduite d’anatoxine diphtérique, un vaccin coquelucheux acellulaire et un vaccin poliomyélitique inactivé (dTCa-VPI), vaccin quadrivalent contre le papillomavirus humain (HPV4), vaccin méningococcique conjugué des sérogroupes A, C, W et Y (MenACWY) et vaccin adsorbé contenant l’anatoxine tétanique, une dose réduite d’anatoxine diphtérique et un vaccin coquelucheux acellulaire (dTca).
En cas d’administration concomitante avec d’autres vaccins, Trumenba doit être administré dans un site d’injection distinct.
Trumenba ne doit pas être mélangé avec d'autres vaccins dans la même seringue.
Fertilité
Les études effectuées chez l’animal n’ont pas mis en évidence d’effets délétères directs ou indirects sur la fertilité des femelles (voir "Données de sécurité préclinique").
Trumenba n’a pas fait l’objet d’une évaluation de l’altération de la fertilité chez les mâles.
Grossesse
Il n’existe pas de données sur l’utilisation de Trumenba chez la femme enceinte. Le risque potentiel pour les femmes enceintes est inconnu. Néanmoins, la vaccination ne doit pas être écartée en présence d’un risque manifeste d’exposition à une infection méningococcique.
Les études de reproduction effectuées chez les lapines n’ont démontré aucun signe d’altération de la fertilité ou de fœtotoxicité liée à l’administration de Trumenba.
Allaitement
On ne sait pas si Trumenba est excrété dans le lait maternel. Trumenba doit être utilisé durant l’allaitement seulement si les avantages possibles l’emportent sur les risques potentiels.
Effets indésirables
1. Résumé des effets indésirables
1.1. Résumé du profil de sécurité
Le profil de sécurité présenté repose sur l’analyse de plus de 17 000 sujets (âgés de 1 an et plus) ayant été vaccinés avec au moins une dose de Trumenba au cours des études cliniques terminées. Chez plus de 16 000 sujets âgés de 10 ans et plus, les effets indésirables les plus fréquemment observés étaient les suivants : céphalées, diarrhée, nausées, douleurs musculaires, douleurs articulaires, fatigue, frissons, ainsi que douleurs, gonflements et rougeurs au site d’injection.
Les effets indésirables consécutifs à la vaccination de rappel chez 301 sujets âgés de 15 à 23 ans ont été similaires aux effets indésirables observés dans le cadre du schéma de primovaccination par Trumenba, environ 4 ans plus tôt.
1.2. Liste des effets indésirables
Les effets indésirables rapportés au cours des études cliniques sont listés par ordre décroissant de fréquence et de gravité, conformément aux catégories de fréquence suivantes :
- très fréquent (≥ 1/10) ;
- fréquent (≥ 1/100, < 1/10) ;
- peu fréquent (≥ 1/1 000, < 1/100) ;
- rare (≥ 1/10 000, < 1/1 000) ;
- très rare (< 1/10 000) ;
- fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Affections du système immunitaire
- Fréquence indéterminée : réactions allergiques *.
Affections du système nerveux
- Très fréquent : céphalées.
Affections gastro-intestinales
- Très fréquent : diarrhée ; nausées.
- Fréquent : vomissements.
Affections musculo-squelettiques et systémiques
- Très fréquent : douleurs musculaires (myalgies) ; douleurs articulaires (arthralgies).
Troubles généraux et anomalies au site d’administration
- Très fréquent : frissons ; fatigue ; rougeur (érythème) ; gonflement (induration) et douleur au site d’injection.
- Fréquent : fièvre ≥ 38 °C (pyrexie).
Population pédiatrique âgée de moins de 10 ans
Enfants/nourrissons
Dans une étude portant sur 294 enfants âgés de 2 à 9 ans, les effets indésirables suivants sont apparus à la fréquence « très fréquent » (≥ 1/10) : céphalées, diarrhée, vomissements, douleurs musculaires, douleurs articulaires, fièvre, fatigue, ainsi que douleurs, gonflements et rougeurs au site d’injection. La fièvre (≥ 38 °C) a été rapportée chez 24,5 % des sujets
Dans une étude portant sur 220 nourrissons âgés de 1 à moins de 2 ans, les effets indésirables suivants sont apparus à la fréquence « très fréquent » (≥ 1/10) : somnolence, irritabilité (agitation), perte ou diminution de l’appétit, fièvre, ainsi que douleurs, gonflements et rougeurs au site d’injection. La fièvre (≥ 38 °C) a été rapportée chez 37,3 % des sujets.
Dans les études cliniques, la fièvre (≥ 38 °C) est apparue plus fréquemment à mesure que l’âge du sujet diminuait. La fièvre a suivi un schéma prévisible après la vaccination : elle est apparue dans les 2 à 4 jours, a duré 1 jour et a été de sévérité légère à modérée. Le taux et la sévérité de la fièvre ont eu tendance à diminuer avec les vaccinations ultérieures par Trumenba.
Vaccination de rappel chez les enfants
Les effets indésirables consécutifs à la vaccination de rappel chez 147 sujets âgés de 3 à 5 ans ont été similaires aux effets indésirables observés dans le cadre du schéma de primovaccination par Trumenba, environ 2 ans plus tôt.
Nourrissons âgés de moins de 1 an
Dans une étude portant sur 115 nourrissons âgés de 2 mois et 48 nourrissons âgés de 6 mois ayant reçu Trumenba ou un vaccin méningococcique recombinant expérimental contenant Trumenba co-administré avec des vaccins autorisés pour ce groupe d’âge, les effets indésirables suivants sont apparus à la fréquence « très fréquent » (≥ 1/10) : somnolence, irritabilité (agitation), perte ou diminution de l’appétit, fièvre, ainsi que douleurs, gonflements et rougeurs au site d’injection.
La fièvre (≥ 38 °C) a été rapportée chez 74 % des sujets, dont 69 % (33 sur 48) des sujets âgés de 6 mois et 76 % (87 sur 115) des sujets âgés de 2 mois. L’apparition d’une fièvre supérieure à 38,9 ˚C-40,0 ˚C était très fréquente (12,0 à 25,0 %) dans les deux groupes d’âge, malgré l’utilisation de paracétamol. Le taux et la sévérité de la fièvre n’ont pas diminué avec la deuxième vaccination chez les nourrissons les plus jeunes.
L’étude a pris fin car deux nourrissons âgés de 2 mois ont développé de la fièvre (39,3 °C et 39 °C, respectivement) après la première vaccination qui, malgré l’utilisation d’antipyrétiques, a nécessité une prise en charge médicale et des investigations comprenant une ponction lombaire. L’analyse du liquide céphalorachidien (LCR) a révélé une pléocytose sans résultats positifs au test microbiologique chez 1 nourrisson. Les deux cas ont été traités comme des infections présumées. Les symptômes ont été résolus chez les deux nourrissons. Les données post-commercialisation ont mis en évidence 3 autres cas de fièvre chez des nourrissons âgés de 1 à 3 mois, ayant nécessité une attention médicale et des investigations comprenant une ponction lombaire, le lendemain de l’administration de Trumenba. L’analyse du LCR n’a révélé aucune pléocytose dans 2 cas et a révélé une pléocytose sans résultats positifs au test microbiologique dans le dernier cas.
2. Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Trumenba n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines. Néanmoins, certains des effets mentionnés dans la rubrique "Effets indésirables" peuvent affecter temporairement la capacité à conduire des véhicules ou à utiliser des machines.
3. Surdosage
L’expérience concernant le surdosage est limitée. En cas de surdosage, le contrôle des fonctions vitales et un traitement symptomatique éventuel sont recommandés.
4. Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Pharmacodynamie
Classe pharmacothérapeutique : vaccins.
Code ATC : J07AH09
1. Mécanisme d’action
Trumenba est un vaccin composé de deux variants de la lipoprotéine recombinante fHbp (protéine deliaison du facteur H). Le fHbp se trouve à la surface des bactéries méningococciques et joue un rôle essentiel car elle permet aux bactéries d’échapper aux défenses immunitaires de l’hôte. Les variants de fHbp se divisent en deux sous-familles immunologiquement distinctes, la sous-famille A et la sous famille B, et plus de 96 % des isolats méningococciques de sérogroupe B en Europe expriment des variants de fHbp de l’une ou l’autre sous-famille à la surface des bactéries.
L’immunisation par Trumenba, qui contient un variant de fHbp de la sous-famille A et un variant de fHbp de la sous-famille B, est destinée à stimuler la production d’anticorps bactéricides capables de reconnaître le fHbp exprimée par les méningocoques. L’étude portant sur l’Expression de l’Antigène Méningococcique de Surface (MEASURE – Meningococcal Antigen Surface Expression) a été développée afin d’établir un rapport entre le niveau d’expression du fHbp de surface et la destruction des souches méningococciques de sérogroupe B dans les tests d’activité sérique bactéricide en présence de complément humain (hSBA). L’analyse de plus de 2 150 isolats de souches invasives de méningocoques de sérogroupe B différents collectés entre 2000 et 2014 dans 7 pays européens, aux États-Unis et au Canada a démontré que plus de 91 % de tous les isolats méningococciques de sérogroupe B exprimaient des niveaux de fHbp suffisants pour être sensibles à la destruction bactéricide par les anticorps induits par le vaccin.
2. Efficacité clinique
L’efficacité de Trumenba n’a pas été évaluée dans le cadre d’essais cliniques. L’efficacité du vaccin a été déduite en démontrant l’induction de réponses en anticorps sériques bactéricides vis-à-vis de quatre souches test de méningocoque de sérogroupe B (voir sous-rubrique "Immunogénicité" ci-dessous). Les quatre souches test expriment des variants de fHbp représentant les deux sous-familles (A et B) et, prises ensemble, elles sont représentatives des souches de méningocoque de sérogroupe B responsables des maladies invasives.
3. Immunogénicité
La protection contre l’infection invasive méningococcique est conférée par les anticorps bactéricides sériques contre les antigènes bactériens de surface. Les anticorps bactéricides agissent de concert avec le complément humain pour détruire les méningocoques. Ce procédé est mesuré in vitro par l’étude de l’activité bactéricide du sérum en présence de complément humain (hSBA) pour le méningocoque de sérogroupe B. Un titre hSBA supérieur ou égal à 1:4 est considéré comme assurant une protection contre l’infection à méningocoque. Au cours d’une analyse d’immunogénicité effectuée avec Trumenba, une réponse a été définie comme un titre hSBA d’au moins 1:8 ou 1:16, selon la souche hSBA.
La couverture vaccinale a été étudiée à l’aide des quatre souches de référence de méningocoque de sérogroupe B : deux exprimant le fHbp de la sous-famille A (variants A22 et A56) et deux exprimant le fHbp de la sous-famille B (variants B24 et B44).
Afin de soutenir et d’élargir l’étendue de la couverture vaccinale, 10 autres souches test de méningocoque de sérogroupe B ont été utilisées, dont six expriment le fHbp de la sous-famille A (variants A06, A07, A12, A15, A19 et A29) et quatre expriment le fHbp de la sous-famille B (variants B03, B09, B15 et B16).
Immunogénicité chez les sujets âgés de 10 ans et plus
L’immunogénicité de Trumenba décrite dans cette rubrique comprend les résultats d’études cliniques de Phase II et de Phase III :
- selon le schéma vaccinal à 2 doses (0 et 6 mois) chez des sujets âgés de 10 à 25 ans aux États- Unis et en Europe (étude B1971057) ;
- selon le schéma vaccinal à 3 doses (0, 2 et 6 mois) chez des sujets âgés de 10 à 25 ans dans le monde entier (études B1971009 et B1971016) ;
- selon les schémas vaccinaux à 2 doses (0 et 6 mois) et à 3 doses (0, 1-2 et 6 mois) chez des sujets âgés de 11 à 18 ans en Europe (étude B1971012).
L’étude B1971057 est un essai de Phase III, multicentrique, randomisé, contrôlé contre comparateur actif, en simple aveugle, au cours duquel des sujets âgés de 10 à 25 ans ont reçu Trumenba aux Mois 0 et 6 (co-administré avec MenACWY-CRM pour la première dose) ou un vaccin méningococcique pentavalent expérimental aux Mois 0 et 6. Au total, 1 057 sujets ont reçu Trumenba et 543 sujets ont reçu le contrôle expérimental. Les titres hSBA pour les souches de référence sont présentés dans le tableau 1. Le tableau 2 présente les titres hSBA contre les 10 autres souches testées qui soutiennent et élargissent l’étendue de la couverture vaccinale démontrée par les 4 souches de référence.
Tableau 1 : titres hSBA chez les sujets âgés de 10 à 25 ans ayant reçu Trumenba selon le schéma vaccinal à 0 et 6 mois pour les souches de référence 1 mois après la 2nde dose (étude B1971057)

MGT = moyenne géométrique des titres ; hSBA = étude de l’activité bactéricide du sérum en présence de complément humain.
1 Une multiplication par un facteur ≥ 4 est définie comme suit : (i) un titre hSBA ≥ 1:16 pour les sujets présentant un titre hSBA initial < 1:4. (ii) Quatre fois le seuil de 1:8 ou 1:16 ou quatre fois le titre hSBA initial, selon le plus élevé des deux, pour les sujets présentant un titre hSBA initial ≥ 1:4.
2 Toutes les souches ont utilisé un seuil de titre de 1:8, sauf A22 dont le seuil était de 1:16.
3 N pour la MGT est le même que celui présenté dans la colonne précédente titre ≥ 1:8 ou 1:16.
4 Proportion de sujets présentant un titre hSBA composite ≥ 1:8 ou 16 pour les quatre souches de référence.
Tableau 2 : titres hSBA chez les sujets âgés de 10 à 25 ans ayant reçu Trumenba selon le schéma vaccinal de 0 et 6 mois pour des souches supplémentaires 1 mois après la 2e dose (étude B1971057)

hSBA = étude de l’activité bactéricide du sérum en présence de complément humain.
(1) Toutes les souches ont utilisé un seuil de titre de 1:8, sauf A06, A12 et A19 dont le seuil était de 1:16.
L’étude B1971009 était un essai de Phase III, multicentrique, randomisé, contrôlé contre comparateur actif, en simple aveugle (observateur) au cours duquel les sujets âgés de 10 à 18 ans ont reçu l’un des trois lots de Trumenba ou le comparateur actif vaccin contre le virus de l’hépatite A (VHA)/solution saline (témoin). Au total, 2 693 sujets ont reçu au moins 1 dose de Trumenba et 897 sujets ont reçu au moins 1 dose de vaccin contre le VHA/solution saline. L’étude a permis d’évaluer la sécurité, la tolérance, l’immunogénicité et la démonstration de la reproductibilité de fabrication de 3 lots de Trumenba administrés selon un schéma vaccinal de 0, 2 et 6 mois. Les titres hSBA pour les souches de référence observées après la troisième dose du lot 1 et du témoin sont présentés dans le tableau 3. Les résultats provenant des lots 2 et 3 ne sont pas présentés, car seules 2 souches représentatives faisaient l’objet d’une évaluation. Les résultats observés pour les lots 2 et 3 étaient semblables à ceux observés pour le lot 1.
L’étude B1971016 était un essai de Phase III, multicentrique, randomisé, contrôlé contre placebo, en simple aveugle (observateur) au cours duquel les sujets âgés de 18 à 25 ans ont été répartis pour recevoir soit Trumenba aux Mois 0, 2 et 6, soit la solution saline aux Mois 0, 2 et 6 selon un ratio de 3:1. Au total, 2 471 sujets ont reçu Trumenba et 822 sujets ont reçu la solution saline. Les titres hSBA pour les souches de référence observées après la troisième dose sont présentés dans le tableau 3.
Tableau 3 : titres hSBA chez des sujets âgés de 10 à 25 ans 1 mois après la 3e dose de Trumenba ou du comparateur selon le schéma vaccinal de 0, 2 et 6 mois pour les souches de référence (étude B1971009 et étude B1971016)

MGT = moyenne géométrique des titres ; hSBA = étude de l’activité bactéricide du sérum en présence de complément humain ; VHA = vaccin contre le virus de l’hépatite A.
1 Une multiplication par un facteur ≥ 4 est définie comme suit : (i) un titre hSBA ≥ 1:16 pour les sujets présentant un titre hSBA initial < 1:4. (ii) Quatre fois le seuil de 1:8 ou 1:16 ou quatre fois le titre hSBA initial, selon le plus élevé des deux, pour les sujets présentant un titre hSBA initial ≥ 1:4.
2 Proportion de sujets présentant un titre hSBA composite ≥ 1:8 ou 16 pour les quatre souches de référence combinées.
Au cours des études B1971009 et B1971016, la proportion des sujets ayant atteint un titre hSBA ≥ 1:8 (variants A07, A15, A29, B03, B09, B15, B16) ou 1:16 (variants A06, A12, A19) contre les 10 souches test supplémentaires après 3 doses de Trumenba, administrées selon un schéma vaccinal de 0, 2 et 6 mois, a été déterminée. Dans les deux études, la majorité des sujets, allant de 71,3 % à 99,3 % pour les 6 souches fHbp de la sous-famille A et de 77,0 % à 98,2 % pour les 4 souches fHbp de la sous-famille B, ont atteint un titre hSBA ≥ 1:8 ou 16, en cohérence avec les résultats observés avec les 4 souches de référence.
Dans l’étude B1971012, une étude de Phase II menée chez des sujets âgés de 11 à 18 ans en Europe, les titres hSBA après la fin de deux schémas vaccinaux en 3 doses (0, 1 et 6 mois et 0, 2 et 6 mois) et d’un schéma vaccinal en 2 doses (0, 6 mois) ont été déterminés contre les 4 souches de référence. Un mois après la troisième dose, des réponses immunitaires robustes et larges similaires ont été observées pour les deux schémas vaccinaux en 3 doses, avec 86,1 % à 99,4 % des sujets ayant atteint des titres hSBA ≥ 1:8 ou 16 et 74,6 % à 94,2 % ayant eu une multiplication par un facteur 4 du titre hSBA. Un mois après la fin du schéma vaccinal en 2 doses (0, 6 mois), 77,5 % à 98,4 % des sujets ont atteint des titres hSBA ≥ 1:8 ou 16 et 65,5 % à 90,4 % ont eu une multiplication par un facteur 4 du titre hSBA.
L’étude B1971033 était une étude de suivi, en ouvert, menée chez des sujets précédemment inclus dans une étude principale, notamment l’étude B1971012. Les sujets ont participé à des visites sur plus de 4 ans pour effectuer des prises de sang et ont reçu une dose de rappel de Trumenba environ 4 ans après une primovaccination de 2 ou 3 doses de Trumenba. Les titres hSBA 4 ans après la primovaccination et 26 mois après la dose de rappel pour les sujets inclus dans les Groupe 1 (schéma de 0, 1 et 6 mois), Groupe 2 (0, 2 et 6 mois) et Groupe 3 (0 et 6 mois) de l’étude principale B1971012 sont présentés dans le tableau 4. Une réponse de rappel mesurée en hSBA a été observée à 1 mois suivant l’administration d’une dose de Trumenba environ 4 ans après une primovaccination de 2 doses (Groupe 3) ou de 3 doses (Groupes 1 et 2).
Tableau 4 : titres hSBA chez des sujets âgés de 11 à 18 ans ayant reçu Trumenba selon le schéma vaccinal de 0, 1, 6 mois ; 0, 2, 6 mois ; et 0, 6 mois et une dose de rappel 4 ans après la fin de la primovaccination (étude B1971033)


hSBA = étude de l’activité bactéricide du sérum en présence de complément humain ; NE = non évalué ; MGT = moyenne géométrique des titres.
1 Toutes les souches ont utilisé un seuil de titre de 1:8, sauf A22 dont le seuil était de 1:16.
2 Les sujets n’ont pas fait l’objet d’un suivi au-delà de 12 mois après la dose de rappel.
3 Proportion de sujets présentant un titre hSBA composite ≥ 1:8 ou 16 pour les quatre souches de référence combinées.
Les échantillons de sérum ont été analysés simultanément dans le cadre de la même campagne sérologique pour tous les temps d’évaluation, à l’exception du temps d’évaluation de 12 mois après la dose de primovaccination pour lequel les résultats proviennent de l’analyse intermédiaire.
Immunogénicité chez les populations particulières
Personnes âgées de 10 ans et plus présentant un déficit en complément ou un dysfonctionnement de la rate
L’étude B1971060 était une étude de phase IV au cours de laquelle 53 participants âgés de 10 ans et plus présentant une asplénie fonctionnelle ou anatomique (N = 51) ou un déficit en complément (N = 2) ont reçu Trumenba aux mois 0 et 6. Les données de sécurité et d’immunogénicité ont été comparées à des données historiques issues de 53 patients-témoins en bonne santé, d’âge et de sexe identiques, ayant reçu Trumenba selon le même schéma. Les proportions de sujets présentant des titres hSBA ≥ 1:8 ou 1:16 par rapport aux 4 souches de référence testées après 2 doses de Trumenba 1 mois après la seconde dose de vaccin sont présentées dans le Tableau 5.
Tableau 5. Titres hSBA chez les sujets immunodéprimés âgés de 10 ans et plus recevant Trumenba selon le schéma vaccinal de 0 et 6 mois pour les souches de référence 1 mois après la 2° étude (étude B1971060), par rapport à la population témoin (étude B1971057)
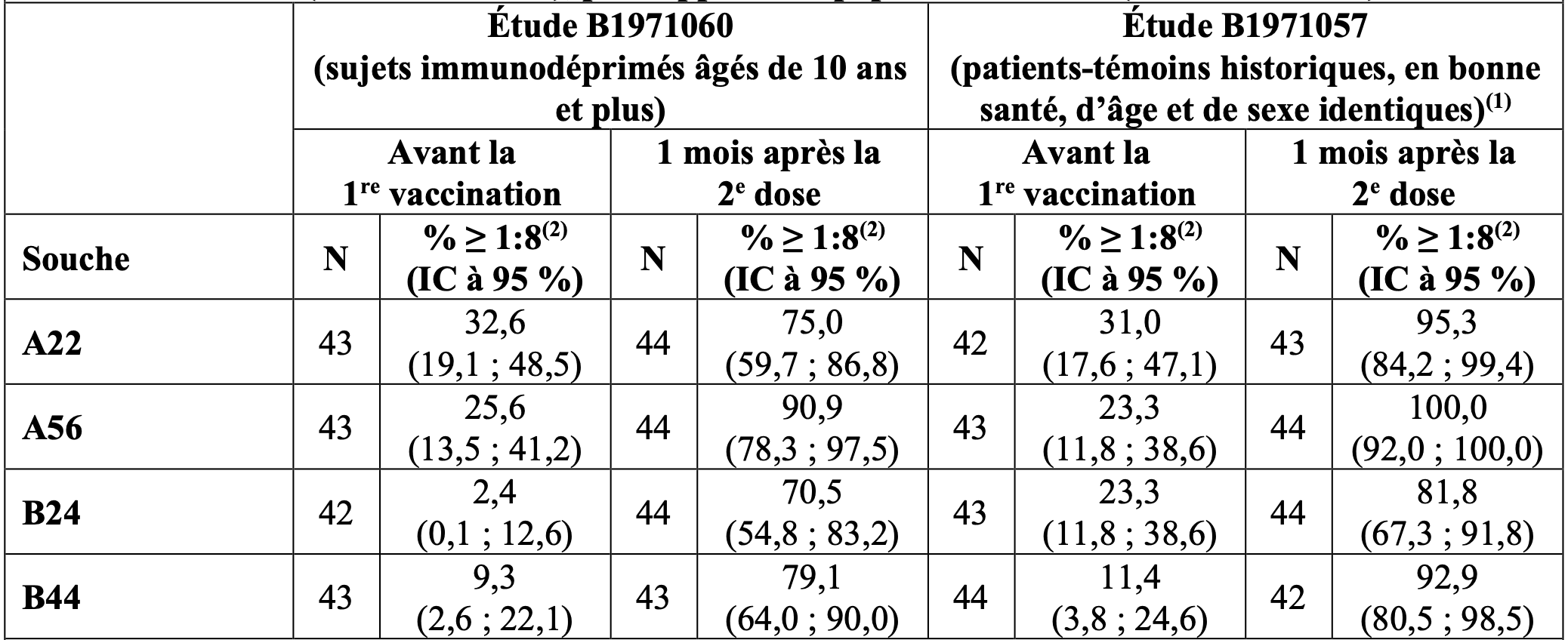
(1) La population témoin en bonne santé incluait des sujets âgés de 10 à 25 ans.
(2) Toutes les souches ont utilisé un seuil de titre de 1:8, sauf A22 dont le seuil était de 1:16.
Immunogénicité chez les sujets âgés de 1 à 9 ans
L’immunogénicité de Trumenba (schéma vaccinal de 0, 2 et 6 mois) chez les nourrissons et les enfants âgés de 1 à 9 ans a été évaluée dans 2 études de Phase II. Un mois après la fin du schéma, 81,4 % à 100 % des sujets ont obtenu un seuil de titre hSBA défini contre les quatre souches de référence de méningocoque (hSBA ≥ 1:16 pour A22 ; ≥ 1:8 pour A56, B24 et B44), contre 0,4 % à 6,5 % initialement.
Les données sur la persistance après la fin de la primovaccination chez les nourrissons âgés de 1 à moins de 2 ans indiquent que 12,4 %, 59,1 %, 10,3 % et 40,4 % des sujets à 6 mois et 3,7 %, 22,8 %, 3,7 % et 12,5 % des sujets à 24 mois après la fin du schéma ont maintenu des titres hSBA ≥ 1:8 ou 1:16 contre les souches de référence A22, A56, B24 et B44, respectivement. Une réponse immunitaire anamnestique a été observée lorsque ces enfants ont reçu une dose de rappel environ 24 mois après la fin de la primovaccination à l’âge de 3 à 5 ans, 92,6 % à 100,0 % obtenant des titres hSBA ≥ 1:8 ou 1:16 contre les 4 souches de référence.
Chez les enfants âgés de 2 à 9 ans, 6 mois après la fin du schéma vaccinal, 32,5 %, 82,4 %, 15,5 % et 10,4 % des enfants ont maintenu des titres hSBA ≥ 1:8 ou 1:16 contre les souches de référence respectivement A22, A56, B24 et B44. Il n’existe pas de données sur la persistance au-delà de 6 mois ou sur la dose de rappel dans ce groupe d’âge.
Voir rubrique "Posologie" pour les informations concernant l’utilisation chez les enfants âgés de 1 à 9 ans.
L’Agence européenne des médicaments a différé l’obligation de soumettre les résultats d’études réalisées avec Trumenba dans un ou plusieurs sous-groupes de la population pédiatrique sur la prévention de l’infection invasive méningococcique causée par Neisseria meningitidis de sérogroupe B (voir rubrique "Posologie" pour les informations concernant l’usage pédiatrique).
Conservation
Durée de conservation : 4 ans.
À conserver au réfrigérateur (entre 2 °C et 8 °C).
Les seringues doivent être conservées au réfrigérateur, horizontalement, afin de réduire le temps de redispersion.
Ne pas congeler.
Manipulation
Pendant la conservation, un dépôt blanc et un surnageant clair peuvent être observés dans la seringue préremplie contenant la suspension.
Avant utilisation, la seringue préremplie doit être agitée vigoureusement afin de garantir l’obtention d’une suspension blanche homogène.
Ne pas utiliser le vaccin si le contenu ne peut pas être remis en suspension.
Le vaccin doit être inspecté visuellement pour mettre en évidence la présence de particules et un changement de coloration avant administration. En présence de particules étrangères et/ou d’un changement de l’aspect physique, ne pas administrer le vaccin.
Ne pas mélanger Trumenba avec d’autres vaccins ou médicaments dans la même seringue.
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments.
L'administration du vaccin doit être consignée par le médecin sur le carnet de vaccination ou de santé avec le numéro de lot. Il peut aussi être inscrit par le patient ou son médecin sur un carnet de vaccination numérique (version grand public ou professionnelle).
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Autres informations
Données de sécurité préclinique
Les données non cliniques issues des études conventionnelles de toxicologie en administration répétée, et des fonctions de reproduction et de développement n’ont pas révélé de risque particulier pour l’homme.
Remboursement
Ce vaccin sera remboursé à 65 % par l'assurance maladie.