ENCEPUR
Laboratoire : Bavarian Nordic A/S
Titulaire de l'AMM : Bavarian Nordic.
Distributeur en France : Valneva.
Ce vaccin est interchangeable avec TICOVAC en cas de pénurie.
Mise à jour le 23/01/2026 : la durée de conservation passe de 3 à 1 an.
Description
Vaccin entier inactivé contre l'encéphalite à tiques, souche K23.
Forme et Présentation
ENCEPUR 1,5 microgrammes / 0,5 mL, suspension injectable en seringue préremplie.
Nature et contenu de l'emballage extérieur
0,5 mL de suspension en seringue préremplie (verre de type I) avec bouchon-piston (bromobutyl) et aiguille attachée munie d’un protège-aiguille (caoutchouc contenant du latex).
Boîte de 1, 10 ou 20.0,5 mL de suspension en seringue préremplie (verre de type I) avec bouchon-piston (bromobutyl) et aiguille séparée.
Boîte de 1, 10 ou 20.
Toutes les présentations peuvent ne pas être commercialisées.
Composition
Une dose (0,5 mL) contient :
1. Antigène
- Virus inactivé de l'encéphalite à tiques 1,2 (souche K23) : 1,5 microgrammes.
2 Adsorbé sur de l’hydroxyde d’aluminium, hydraté (0,3 – 0,4 milligrammes Al³+).
2. Excipients
- Saccharose
- Chlorure de sodium
- Trométamol
- Eau pour préparations injectables
Traces et résidus de fabrication
ENCEPUR contient des traces de formaldéhyde, de chlortétracycline, de gentamycine et de néomycine et peut contenir des résidus d’œufs et de protéines de poulet (voir rubriques "Contre-indications" et "Mises en garde et précautions d'emploi").
Indications
ENCEPUR est indiqué pour l'immunisation active (prophylactique) contre l'encéphalite à tiques chez les adultes et les enfants à partir de 12 ans.
ENCEPUR doit être administré selon les recommandations officielles définissant les besoins et le calendrier de vaccination contre l'encéphalite à tiques.
Posologie
Une dose de 0,5 mL est administrée aux adultes et aux adolescents à partir de l’âge de 12 ans.
1. Schéma de primo-vaccination
Le schéma de primo-vaccination consiste en 3 doses et est préférablement administré durant les mois plus froids (hiver),afin de fournir une protection durant la période à risque (printemps/été).
ENCEPUR peut être administré selon les schémas suivants :
1.1. Schéma conventionnel
- 1ère dose : Jour 0
- 2edose : 14 jours à 3 mois après la 1ère dose *
- 3edose:9 à 12 mois après la 2ème dose
1.2. Schéma de vaccination express
- 1ère dose : Jour 0
- 2e dose : Jour 7
- 3e dose : Jour 21
Le schéma conventionnel est à utiliser de préférence pour les patients restant exposés à des risques d'infection. Le schéma express est choisi pour des personnes nécessitant une immunisation rapide.La séroconversion est généralement assurée au plus tôt 14 jours après la seconde injection.
Après la finalisation du schéma de primo-vaccination, les titres en anticorps sont maintenus au moins pendant 12 à 18 mois(après le schéma de vaccination rapide) ouau minimum3 ans (schéma conventionnel), date après laquelleunepremière dosede rappelestrecommandée.
Se référer à la rubrique "Mises en garde et précautions d'emploi" pour plus d’informations concernant la vaccination des personnes ayant un dysfonctionnement du système immunitaire.
2. Vaccination de rappel
Suite à une vaccination initiale avec l’un des 2 schémas de vaccination, une dose de rappel doit être administrée de la manière suivante :
2.1. Schéma express
2.1.1. Personnes âgées de 12 à 49 ans
- Première dose de rappel : 12 à 18 mois après avoir finalisé le schéma de primo-vaccination recommandé
- Autres doses de rappel : Tous les 5 à 10 ans *
2.1.2. Personnes âgées de plus de 49 ans
- Première dose de rappel : 12 à 18mois après avoir finalisé le schéma de primo-vaccination recommandé
- Autres doses de rappel : Tous les 3 ans
2.2. Schéma conventionnel / rapide
2.2.1. Personnes âgées de 12 à 49 ans
- Première dose de rappel : 3 ans après avoir finalisé le schéma de primo-vaccination
- Autres doses de rappel : Tout les 5 à 10 ans *
2.2.2. Personnes âgées de plus de 49 ans
- Première dose de rappel : 3 ans après avoir finalisé le schéma de primo-vaccination
- Autres doses de rappel : Tous les 3 ans
Selon les recommandations officielles de l’Organisation Mondiale de la Santé (OMS), après la primo-vaccination avec un autre vaccin contre l’encéphalite à tiques cultivé sur cellules (3 doses), ENCEPUR peut être administré comme vaccin de rappel.
Mode d'administration
Ce vaccin doit être injecté par voie intramusculaire, de préférence dans la région deltoïdienne.
Si nécessaire (par exemple chez les sujets présentant des troubles de la coagulation), ENCEPUR peut être administré par voie sous-cutanée.
Contre-indications
Hypersensibilité à la substance active, à l'un des excipients mentionnés à la rubrique "Composition", ou aux résidus de production (formaldéhyde, chlorhydrate de chlortétracycline, gentamycine, néomycine).
Hypersensibilité sévère aux protéines d'œuf et de poulet (réaction anaphylactique après ingestion orale de protéines d'œuf).
La vaccination contre l'encéphalite à tiques doit être différée si la personne souffre d'une maladie fébrile aiguë.
Mises en garde et précautions d'emploi
En règle générale, l'allergie non grave aux protéines d'œufet de poulet(diagnostic basé uniquement sur l’interogatoire ou un test cutanée) n’augmente pas le risque associé à la vaccination avec ENCEPUR.
Comme pour tous les vaccins injectables, il est recommandé de toujours disposer d'un traitement médical approprié et de s’assurer de surveiller les cas rares de réaction anaphylactique survenant après administration du vaccin.L'administration intravasculaire doit être strictement évitée car elle pourrait entraîner des réactions sévères, incluant des réactions d’hypersensibilité avec état de choc.
Comme pour tous les vaccins, ENCEPUR peut ne pas entraîner de protection de l’ensemble des sujets vaccinés.
Lorsqu’il est nécessaire de réaliser un dosage sérologique afin de déterminer la nécessité de réaliser des injections supplémentaires, il est recommandé de faire déterminer la concentration d'anticorps par un laboratoire qualifié. En effet, des réactions croisées avec des anticorps anti-flavivirus préexistants, soit par exposition naturelle, soit par vaccination (par exemple encéphalite japonaise, fièvre jaune, fièvre due à la dengue…) sont possibles et peuvent facilement entraîner des faux positifs.
En cas de maladie auto-immune avérée ou suspectée chez le sujet devant être vacciné, le bénéfice de la vaccination par ENCEPUR doit être évalué par rapport au risque d'aggraver la pathologie existante.Un examen approfondi du rapport bénéfice/risque est nécessaire pour déterminer l’intérêt d’une vaccination chez les sujets atteints d’affections neurologiques sévères pré-existantes.
Une seule injection de ENCEPUR peut ne pas prévenir la survenue d’une encéphalite à tiques, en cas de morsure de tiques survenant avant ou pendant les 2 semaines suivant la 1ère injection.
Une morsure de tique peut transmettre des infections autres que l’encéphalite à tiques, incluant certains agents pathogènes (tels que les bactéries du genreBorrelia) dont la symptomatologie des infections peut ressembler à celle de l'encéphalite à tiques. Aussi, les signes cliniques et les symptômes traduisant une possible encéphalite à tiques chez un sujet vacciné doivent être correctement évalués de façon à éliminer une autre source potentielle de contamination.
Des réactions en rapport avec l’anxiété, y compris des réactions vaso-vagales (syncope), de l’hyperventilation ou des réactions en rapport avec le stress peuvent survenir lors de la vaccination comme réaction psychogène à l’injection avec une aiguille (voir rubrique "Effets indésirables"). Il est important que des mesures soient mises en place afin d’éviter toute blessure en cas d’évanouissement.
Chez les patients recevant un traitement immunosuppresseur ou chez les patients présentant une immunodéficience (iatrogéniqueetliée à l’âge), on peut s’attendre à une réponse immunitaire inadéquate. Dans ces cas, le taux d’anticorps doit être évalué en utilisant des techniques sérologiques, et, si nécessaire, une dose supplémentaire du vaccin devra être administrée.
ENCEPUR contient du sodium. Le taux de sodium est inférieur à 1 mmol par dose administrée, c’est-à-dire « sans sodium ».
En cas d'allergie connue au latex
Seringue préremplie avec aiguille séparée
Bien qu'aucun latex de caoutchouc naturel n'ait été détecté dans le capuchon de la seringue, la sécurité d'utilisation d'ENCEPUR chez les personnes sensibles au latex n'a pas été établie.
Seringue préremplie avec une aiguille attachée
Le protège-aiguille est fabriqué à partir de caoutchouc naturel contenant dulatex. Les personnes sensibles au latex peuvent potentiellement développer une réaction allergique suite au contact avec le protège-aiguille.
Interactions
Un taux d’anticorps protecteurs peut ne pas être atteint chez les sujets sous traitement immunosuppresseur ou présentant un déficit immunitaire. Dans ce cas, les concentrations d'anticorps doivent être déterminées pour vérifier la réponse à la vaccination et la nécessité de réaliser des injections supplémentaires.
Aucune étude d'interaction avec d'autres vaccins n'a été réalisée.
Des sites d’injection différents doivent être utilisés si plusieurs vaccins injectables sont administrés en même temps.
Grossesse
Il n'existe aucune données sur l’utilisation de ce vaccin chez la femme enceinte, ni aucune étude de reproduction animale adéquate. En conséquence, ENCEPUR ne sera administré durant la grossesse que si une protection contre l’encéphalite à tiques est urgente et après évaluation minutieuse du rapport bénéfice/risque.
Allaitement
Aucune donnée ne permet de savoir si ENCEPUR passe dans le lait maternel. En conséquence, ENCEPUR ne sera administré durant l'allaitement que si une protection contre l'encéphalite à tiques est urgente et après évaluation minutieuse du rapport bénéfice/risque.
Effets indésirables
Les effets indésirables suivants ont été rapportés au cours d’études cliniques randomisées, contrôlées ayant inclu 3223 sujets. Les effets indésirables observés au cours des essais cliniques sont présentés par système classe-organe selon la terminologie MedDRA. Au sein de chaque classe de système-organe, les effets indésirables sont classés par fréquence, avec les réactions les plus fréquentes présentées en premier. Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité. De plus, la catégorie de fréquence classée selon la convention (CIOMS III) suivante est également fournie pour chaque effet indésirable.
1. Liste des effets indésirables
Les fréquences sont définies comme suit :
- très fréquent (≥ 1/10 ) ;
- fréquent (≥ 1/100, <1/10) ;
- peu fréquent (≥ 1/1000, <1/100) ;
- rare (≥ 1/10 000, <1/1000) ;
- très rare (< 1/10 000).
1.1. Effets indésirables rapportés lors des essais cliniques
Affections du système nerveux
- Très fréquent : céphalée.
Affections gastro-intestinales
- Fréquent : nausées.
- Peu fréquent : vomissements.
Affections musculo-squelettiques et du tissu conjonctif
- Très fréquent : myalgie.
- Fréquent : arthralgie.
Troubles généraux et anomalies au site d'administration
- Très fréquent : douleurs au site d'injection, malaise.
- Fréquent : fièvre > 38 °C, érythème et œdème au site d’injection, syndrome pseudo-grippal.
Description de certains effets indésirablesrapportés lors des essais cliniques:
Un syndrome pseudo-grippal (incluant fièvre,hyperhidrose, rigidité) survient fréquemment, en particulier après la primo-vaccination. Ces symptômes régressent en général dans les 72 heures.
Les effets indésirables suivants ont été identifiés en s’appuyant sur les notifications spontanées post-commercialisation et sont organisés en systèmes classe-organe. Ces réactions étant notifiées de manière volontaire par une population de taille incertaine, il n’est pas toujours possible d’en estimer leur fréquence de façon fiable.
1.2. Effets indésirables rapportés pendant la surveillance post commercialisation
Affections hématologiques et du système lymphatique
- Lymphadénopathies.
Affections du système immunitaire
- Réactions allergiques.
Affections du système nerveux
- Paresthésie, vertige, présyncope, syncope.
Affections gastro-intestinales
- Diarrhée.
Affections musculo-squelettiques et du tissu conjonctif
- Myalgie, arthralgie.
Troubles généraux et anomalies au site d’administration
- Granulome au site d’injection, fatigue, asthénie.
Description des effets indésirables rapportés spontanément post commercialisation :
Réactions allergiques tels qu’urticaire généralisé, angiœdème, stridor, dyspnée, bronchospasme, hypotension et autres troubles circulatoires pouvant être accompagnés de troubles transitoires et non spécifiques de la vision, ainsi que thrombocytopénie transitoire, qui peut également être sévère.
Paresthésie pouvant être décrite par un engourdissement ou des picotements.
Myalgies etarthralgieslocaliséesdans la région cervicaleetpouvant indiquer un syndrome méningé. Ces symptômes sont très rares et vont régresser sans séquelles en quelques jours.
Granulome au site d’injectionétantoccasionnellement accompagné d’un sérome.
2. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
ENCEPUR n’a qu’une influence mineure sur l’aptitude à conduire des véhicules et à utiliser des machines.
3. Surdosage
Aucun cas de surdosage n’a été rapporté.
4. Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Pharmacodynamie
Classe pharmacothérapeutique : Vaccins contre les encéphalites, encéphalite transmise par les tiques, virus entier inactivé.
Code ATC : J07BA01.
Dans nos études cliniques, un test TN validé a été utilisé ;un score de TN>2est indicatif d’une séro-positivité, et un score de TN≥10 a été choisi comme le seuil d’anticorps le plus conservateur pouvant être considéré comme cliniquement significatif.
1. Primo-vaccination
Un total de 12 études cliniques, allant de la phase I à la phase IV et incluant plus de 2600 adolescents et adultes, ont été conçues afin d’évaluer la réponse immunitaire et la tolérance des différents schémas de primo-vaccination ou de rappel d'ENCEPUR.
Le pourcentage de sujets ayant des anticorps contre l’encéphalite à tiques TN ≥10 et les moyennes géométriques des titres (MGT) respectifs sont présentés dans le tableau suivant :
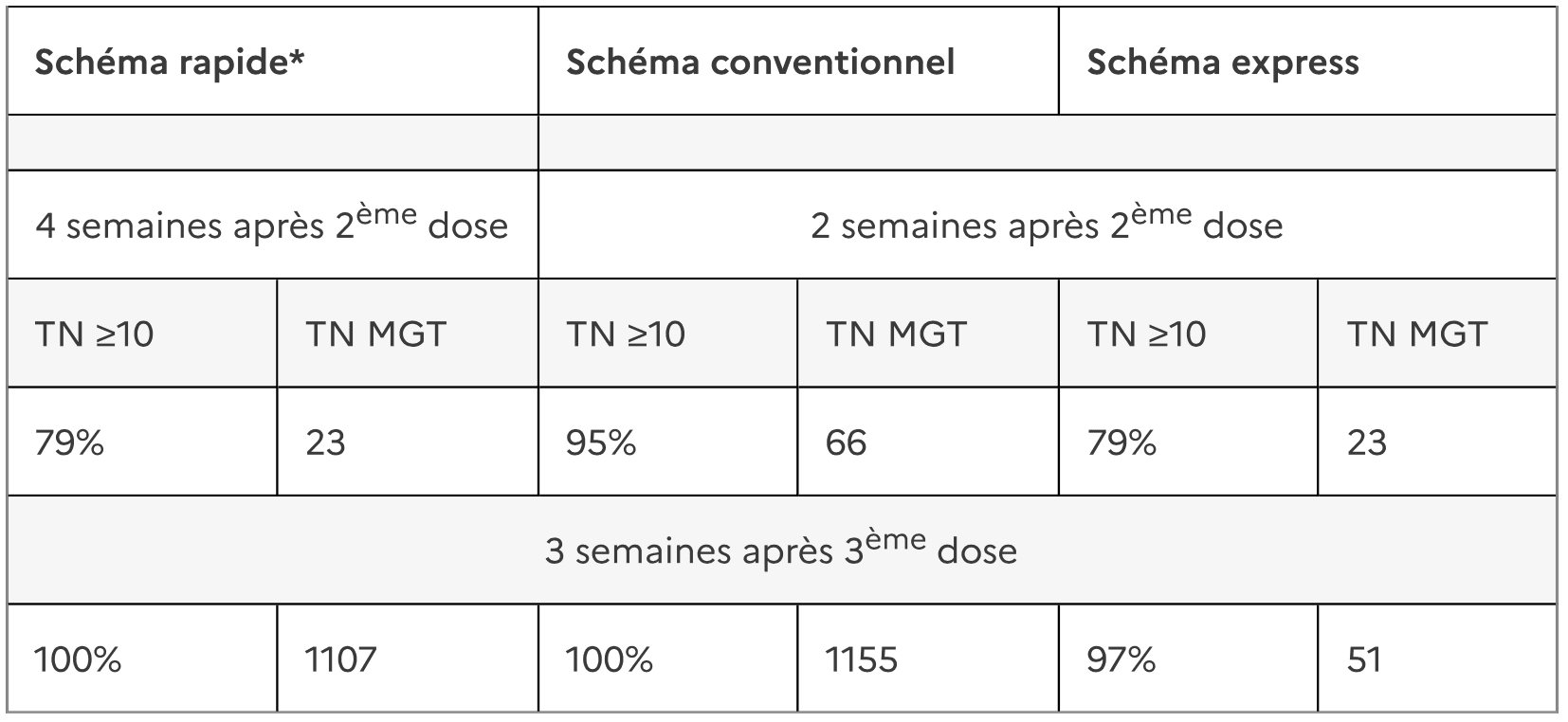
La séroconversion est attendue environ 14 jours après la 2ème vaccination lorsqu’un schéma de vaccination express est utilisé.
2. Doses de rappel
Le pourcentage d’adolescents et d’adultes ayant des titres en anticorps contre l’encéphalite à tiques TN ≥ 10 après la dose de rappel est présenté dans le tableau suivant :

Les TN et MGT mesurés étaient comparables quel que soit le schéma de primo-vaccination.
Les données publiées sur les personnes vaccinées ayant reçus le schéma de primo-vaccination à 3 doses indiquent que ENCEPUR induit aussi la formation des anticorps contre diverses souches de l’Extrême-Orient du virus contre l’encéphalite à tiques.
Conservation
Durée de conservation : 1 an.
A conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler.
Ne pas utiliser ce vaccin s'il a été congelé.
Manipulation
Bien agiter la seringue avant l'emploi pour mettre le vaccin en suspension. Après agitation, le vaccin se présente comme une suspension blanche, légèrement opaque.
Jeter le vaccin en cas d’apparence anormale.
En l’absence d’étude de compatibilité, ce vaccin ne doit pas être mélangé avec d’autres médicaments.
L'administration du vaccin doit être consignée par le médecin sur le carnet de vaccination ou de santé avec le numéro de lot. Il peut aussi être inscrit par le patient ou son médecin sur un carnet de vaccination numérique (version grand public ou professionnelle).
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Remboursement
Prix libre, médicament non remboursable.
Cette présentation est agréée aux collectivités.