RABIPUR
Laboratoire : Bavarian Nordic A/S
Le titulaire de l'autorisation de mise sur le marché de ce vaccin est le laboratoire Bavarian Nordic. Ce vaccin est distribué en France par Valneva (selon un accord entre les deux laboratoires).
Mise à jour du 28/11/2023 : nouveau schéma à 2 doses en pré-exposition. Mise à jour du 27/08/2024 : voir rubrique manipulation une nouvelle note du fabricant.
Mise à jour du 20/11/2025 : ajout d'une nouvelle présentation (Voir « Manipulation »).
Description
Vaccin rabique entier inactivé, cultivé sur cellules d’embryon de poulet (PCEC), inactivation par la ß-propiolactone.
Interchangeabilité
Forme et Présentation
RABIPUR, poudre et solvant pour solution injectable en seringue préremplie.
La poudre est blanche.
Le solvant est limpide et incolore.
Après reconstitution de la poudre avec le solvant, la solution obtenue est claire et incolore.
Nature et contenu de l'emballage extérieur
Boîte contenant :
- 1 flacon de poudre (verre de type I) contenant l'antigène lyophilisé, muni d'un bouchon (chlorobutyle ou bromobutyle)
- 1 seringue préremplie jetable (verre de type I) contenant le solvant stérile de reconstitution (1 mL) munie
- soit d’un capuchon scellé blanc (polypropylène), d’un capuchon d’embout (bromobutyle) et d'un bouchon-piston (bromobutyle)
- soit d’un capuchon à vis transparent (polypropylène), d’un capuchon d’embout (isoprène-bromobutyle) et d’un bouchon-piston (isoprène-bromobutyle)
2 aiguilles identiques (25 G, 25 mm) – une pour la reconstitution et une pour l’administration.
Présentations :
- 1 flacon et 1 seringue préremplie munie d’un capuchon scellé blanc avec des aiguilles
- 1 flacon et 1 seringue préremplie munie d’un capuchon à vis transparent avec des aiguilles
Toutes les présentations peuvent ne pas être commercialisées.
Composition
Une dose de 1 mL de solution reconstituée contient :
1. Antigène
- Virus de la rage* (inactivé, souche Flury LEP) ≥ 2,5 UI
2. Excipients
- Trométamol
- Chlorure de sodium
- Edétate disodique
- L-glutamate de potassium
- Polygéline
- Saccharose
3. Résidus de fabrication (à l'état de traces)
- Amphotéricine B
- Chlortétracycline chlorhydrate (résidu de fabrication)
- Néomycine
- Protéines d'oeuf
- Protéines de poulet (telle que ovalbumine)
- Sérum-albumine humaine
Indications
RABIPUR est indiqué dans l'immunisation active contre la rage chez des personnes de tous âges. Voir rubriques "Posologie" et "Pharmacodynamie" pour obtenir des informations détaillées sur la prophylaxie pré et post-exposition.
- Vaccination de préexposition (avant risque possible d'exposition à la rage).
- Traitement de postexposition (après exposition connue ou possible à la rage).
Les recommandations nationales ou de l'OMS concernant la prévention de la rage doivent être prises en compte.
L'avis du Haut Conseil de la santé publique publié le 22 février 2013 actualise les recommandations relatives à la vaccination antirabique préventive, au traitement post-exposition et au suivi sérologique des personnes régulièrement exposées au virus de la rage (voyageurs, professionnels, chiroptérologues).
Posologie
La dose recommandée pour la primo-vaccination et pour les rappels est de 1,0 mL.
1. Prophylaxie pré-exposition
1.1. Primo-vaccination
Pour améliorer la compréhension de l'information, nous avons modifié la présentation des schémas de vaccination en respectant le contenu du RCP. A noter que la possibilité d'utiliser le schéma à 2 doses chez les personnes immunodéprimées n'est pas évidente à la lecture du RCP pour une raison de mise en page, la phrase sur la nécessité d'un contrôle sérologique n'étant pas intégrée au paragraphe concernant les personnes immunodéprimées.
1.1.1. Personnes immunocompétentes
- Schéma conventionnel à 3 doses : 1 dose à J0, J7, et J21 ou J28
- Schéma accéléré à 3 doses : 1 dose à J0, J3 et J7 *
- Schéma à 2 doses : 1 dose à J0 et J7
En pratique, on fait le schéma à 2 doses en pré-exposition chez le voyageur ! Les schémas à 3 doses étaient déjà autorisés mais il n'y pas de raison de les privilégier, sauf chez les professionnels exposés (vétérinaires par exemple).
1.1.2. Personnes immunodéprimées
- Schéma conventionnel à 3 doses : 1 dose à J0, J7, et J21 ou J28
- Schéma accéléré à 3 doses : 1 dose à J0, J3 et J7 * **
- Schéma à 2 doses : 1 dose à J0 et J7**
** Le schéma accéléré à 3 doses et le schéma en une semaine avec 2 doses administrées à jour 0 et à jour 7 sont possibles chez les personnes immunodéprimées s’ils s’accompagnent d’un contrôle sérologique 2 à 4 semaines après l’administration de la première dose de vaccin contre la rage afin d’évaluer si une administration supplémentaire du vaccin est nécessaire. La consultation d’un spécialiste des maladies infectieuses ou d’un immunologue est conseillée.
RABIPUR doit être utilisé conformément aux recommandations officielles.
1.2. Rappel
Des doses de rappel sont généralement recommandées tous les 2 à 5 ans. Le délai d’administration de la dose de rappel après une primo-vaccination avec un schéma accéléré n’a pas encore été établi (voir aussi la rubrique Pharmacodynamie). Le recours à des contrôles sérologiques visant à détecter la présence d'anticorps ≥ 0,5 UI/mL afin d’évaluer la nécessité d'administrer des doses de rappel doit être évalué conformément aux recommandations officielles.
Rabipur peut être utilisé comme vaccin de rappel chez les personnes précédemment vaccinées avec un vaccin rabique cultivé sur cellules diploïdes humaines.
2. Prophylaxie post-exposition
La prophylaxie post-exposition doit démarrer le plus rapidement possible après l'exposition, et doit être accompagnée de mesures locales au site d'inoculation afin de réduire le risque d'infection. Il convient d'obtenir les recommandations officielles concernant les mesures concomitantes appropriées à prendre pour éviter l'infection (voir également "Mises en garde et précautions d'emploi").
La prophylaxie post-exposition doit démarrer le plus rapidement possible après l'exposition.
2.1. Recommandations d'une prophylaxie post-exposition en fonction du type d’exposition
2.1.1. Catégorie d'exposition : I
Type d'exposition avec un animal domestique ou sauvagea enragé ou susceptible de l'être ou un animal ne pouvant être testé
- Toucher ou nourrir des animaux.
- Peau intacte léchée par l'animal.
- Contact de la peau intacte avec des sécrétions ou excrétions d'un animal ou d'un individu atteint de la rage.
Prophylaxie post-exposition recommandée
- Aucune, si une anamnèse fiable peut être obtenue.
2.1.2. Catégorie d'exposition : II
Type d'exposition avec un animal domestique ou sauvagea enragé ou susceptible de l'être ou un animal de pouvant être testé
- Mordillement de la peau nue.
- Griffures bénignes ou abrasions sans saignement.
Prophylaxie post-exposition recommandée
- Administrer immédiatement le vaccinb.
- Arrêter le traitement si l'animal reste sain au cours d'une période d'observation de 10 joursc ou s'il est démontré que le test de détection de la rage chez l'animal testé est négatif. Le test doit être réalisé à l'aide de techniques de dépistage appropriées par un laboratoire fiable.
2.1.3. Catégorie d'exposition : III
Type d'exposition avec un animal domestique ou sauvagea enragé ou susceptible de l'être ou un animal de pouvant être testé
- Morsure ou griffures, uniques ou multiples ayant traversé la peaud, ou peau abrasée léchée par l'animal.
- Contamination d'une muqueuse par la salive (par exemple léchage).
- Exposition à des chauves-sourise.
Prophylaxie post-exposition recommandée
- Administrer immédiatement le vaccin rabique et les immunoglobulines antirabiques, de préférence le plus rapidement possible après le début de la prophylaxie post-exposition. Les immunoglobulines antirabiques peuvent être injectées jusqu'à 7 jours après l'administration de la première dose de vaccin.
- Arrêter le traitement si l'animal reste sain au cours d'une période d'observation de 10 joursc ou s'il est démontré que le test de détection de la rage chez l'animal testé est négatif. Le test doit être réalisé à l'aide de techniques de dépistage appropriées par un laboratoire fiable.
b L'instauration du traitement peut être reportée, s'il s'agit d'un chien ou d'un chat apparemment en bonne santé résidant ou provenant d'une région à faible risque et si l’animal est sous observation.
c Cette période d'observation ne s'applique qu'aux chiens et aux chats. A l’exception des espèces menacées ou en voie de disparition, les autres animaux domestiques ou sauvages suspectés d'être porteurs de la rage devront être euthanasiés et leurs tissus devront être examinés afin de détecter la présence d'antigènes de la rage à l'aide de techniques de laboratoire appropriées.
d Les morsures, en particulier au niveau de la tête, du cou, du visage, des mains et des parties génitales, constituent des expositions de catégorie III en raison de l'importante innervation de ces parties du corps.
e Une prophylaxie post-exposition doit être envisagée en cas de contact entre un individu humain et une chauve-souris, sauf si la personne exposée est certaine de ne pas présenter de morsure, de griffure ou d'exposition d'une muqueuse.
2.2. Schémas de vaccination post-exposition chez des personnes n’ayant jamais été vaccinées contre la rage
- Protocole de "Essen" (5 doses) : 1 dose à J0, J3, J7, J14 et J28
- Protocole de "Zagreb" (4 doses) : 2 doses* à J0, puis 1 dose à J7 et J21
- Protocole de "Essen" réduit (4 doses)** : 1 dose à J0, J3, J7 et J14
** Ce schéma de « Essen » réduit peut être utilisé comme une alternative chez les sujets sains et immunocompétents, dont l’exposition a été classée dans la catégorie II ou III à condition que la morsure soit soignée, que des immunoglobulines et un vaccin rabique pré-qualifié par l’OMS soient administrés.
Chez les personnes qui ont déjà été vaccinées, la prophylaxie post-exposition comprend deux doses administrées aux jours 0 et 3. Dans ce cas, l’administration d’immunoglobulines antirabiques n’est pas nécessaire.
2.3. Conduite à tenir chez les patients immunodéprimés
Chez les patients immunodéprimés et en cas d’exposition de catégorie II et III, 5 doses de vaccin doivent être administrées en association à une prise en charge complète de la plaie et à l'infiltration locale d'immunoglobulines antirabiques comme précisé ci-dessous.
- Protocole de "Essen"* (5 doses) : 1 dose à J0, J3, J7, J14 et J28
- Protocole alternatif au protocole de "Essen" (6 doses) : 2 doses à J0, puis 1 dose à J3, J7, J14 et J28
Si possible, le titre d'anticorps neutralisants doit être mesuré 2 à 4 semaines (de préférence à J14) après le début de la vaccination afin d'évaluer s'il est nécessaire d'injecter une dose supplémentaire de vaccin. Des agents immunosuppresseurs ne doivent être administrés pendant un traitement post-exposition que s'ils sont indispensables au traitement d'autres pathologies (voir rubrique "Interactions").
Population pédiatrique
Les enfants reçoivent la même dose que les adultes (1,0 mL).
Mode d'administration
RABIPUR doit être injecté par voie intramusculaire uniquement. Chez les adultes et enfants âgés de 2 ans et plus, le vaccin doit être administré dans le muscle deltoïde. Chez les enfants âgés de moins de 2 ans, il est recommandé de vacciner dans la région antérolatérale de la cuisse.
Recommandations de la Haute Autorité de santé sur la voie d'administration.
La Haute Autorité de santé (HAS) recommandait en 2018 (avis du 15/09/2018) la vaccination des personnes exposées à la rage en prophylaxie post-exposition par le vaccin Rabipur ou le vaccin rabique Pasteur :
soit par voie intradermique ; situation hors-autorisation de mise sur le marché (AMM) en France ;
soit par voie intramusculaire.
Le Vaccin Rabique Pasteur ayant obtenu une autorisation de mise sur le marché en mars 2022, ce vaccin sera préférentiellement utilisé si la voie intradermique est choisie.
Les recommandations de vaccination contre la rage en prophylaxie pré-exposition seront produites ultérieurement.
Contre-indications
Vaccination de pré-exposition (PrPE)
- Antécédents de réaction d'hypersensibilité sévère à la substance active ou à l'un des excipients ou l'un des résidus mentionnés à la rubrique "composition".
- La vaccination doit être reportée chez les sujets souffrant d'une maladie fébrile sévère (voir rubrique "Mise en garde").
Prophylaxie de post-exposition (PPE)
- En raison de l'évolution presque systématiquement fatale de la rage, il n'existe aucune contre-indication à la prophylaxie post-exposition.
Mises en garde et précautions d'emploi
Une réponse immunitaire protectrice peut ne pas être obtenue chez tout les sujets vaccinés.
En cas d'affections aiguës nécessitant un traitement, la vaccination sera différée d'au moins deux semaines après la guérison des patients. Une infection mineure ne doit pas conduire à un report de la vaccination.
1. Réactions d'hypersensibilité (uniquement lors de la PPE)
Des cas de réaction anaphylactique, y compris de choc anaphylactique, ont été rapportés après une vaccination par RABIPUR. Comme pour tous les vaccins injectables, il est recommandé de toujours disposer d'un traitement médical approprié et de surveiller les individus dans les rares cas de réaction anaphylactique survenant après administration du vaccin.
RABIPUR contient des excipients comme la polygéline, des résidus tels que des protéines de poulet (comme l'ovalbumine), de la sérum-albumine humaine, et peut contenir des traces d'antibiotiques (voir rubrique "composition"). Dans le cas où des sujets auraient développé des symptômes cliniques de réactions anaphylactiques tel que une urticaire généralisée, un oedème des voies respiratoires supérieures (lèvres, langue, gorge, larynx et épiglotte), des spasmes laryngés ou des bronchospasmes, une hypotension ou un état de choc, suivant l'exposition à l'une de ces substances, la vaccination doit être réalisée uniquement par un personnel ayant la capacité et les moyens de gérer une réaction anaphylactique post-vaccination.
2. Effets sur le système nerveux central
Des cas d'encéphalite et de syndrome de Guillain-Barré ont été temporairement associés à l'utilisation de RABIPUR (voir aussi rubrique "effets indésirables"). Avant de décides d'interrompre la vaccination d'un patient, le risque de développer la rage doit être attentivement évalué.
2.1. Voie d'administration
Le vaccin rabique ne doit être injecté ni dans le muscle fessier ni par voie sous-cutanée, car cela pourrait diminuer l'induction de réponse immunitaire.
Une injection intravasculaire accidentelle peut entraîner des réactions systémiques, y compris un état de choc. Ne pas injecter par voie intravasculaire.
2.2. Réactions anxieuses
Des réactions anxieuses, y compris des réactions vaso-vagales (syncope), de l'hyperventilation ou des réactions liées au stress, peuvent survenir en association avec la vaccination comme réaction psychogène à l'injection avec une aiguille ( voir rubrique "effets indésirables"). Il est important que des mesures soient mises en place afin d'éviter des blessures en cas d'évanouissement.
Ne pas injecter par voie intravasculaire.
Contact avec un animal susceptible d'être atteint par la rage
Suite à un contact avec un animal susceptible d'être atteint de la rage, il est essentiel de suivre les procédures suivantes (d'après l'OMS 1997)
- Traitement immédiat de la blessure.
- Afin d'éliminer le virus rabique, nettoyer immédiatement au savon puis rincer abondamment à l'eau. Ensuite, appliquer de l'alcool (70 %) ou de la teinture d'iode. Si possible, ne pas suturer une plaie due à une morsure ou suturer seulement pour assurer l'apposition.
Vaccination antitétanique et administration d'immunoglobulines rabiques
- Si nécessaire, le traitement sera complété par une prophylaxie antitétanique.
- Lorsqu'une immunisation passive est également indiquée, appliquer autant de la dose recommandée d'immunoglobulines rabiques humaines (IgRH) qu'il est anatomiquement possible de le faire et aussi profondément que possible autour de la plaie et à l'intérieur. S'il en reste, on l'injectera en intramusculaire à un site distant du site d'administration du vaccin, de préférence dans la région fessière. Pour des informations détaillées, se rapporter au résumé des caractéristiques du produit et/ou à la notice d'accompagnement des IgRH.
Interactions
Un traitement immunosuppresseur peut interférer avec le développement de la réponse immunitaire au vaccin rabique. Il est donc recommandé de surveiller les réponses sérologiques chez ces sujets et il peut être nécessaire de leur administrer des doses supplémentaires (voir rubrique "Posologie").
Le vaccin ne doit pas être mélangé dans la même seringue avec d'autres médicaments. S’il est recommandé d’administrer des immunoglobulines antirabiques en plus de la vaccination par RABIPUR, l’administration devra être faite dans un site distant du site d'administration du vaccin.
Les données cliniques disponibles soutiennent l’administration concomitante de RABIPUR avec le vaccin inactivé contre l’encéphalite japonaise et le vaccin méningococcique conjugué ACWY chez les adultes ; les données sont limitées dans la population pédiatrique (voir rubrique "Pharmacodynamie").
Presque tous les sujets adultes ont développé une réponse immunitaire adéquate (anticorps neutralisants du virus de la rage [RVNA] ≥ 0,5 UI/ml) dans les 7 jours suivant la fin d’une primo-vaccination en trois injections de RABIPUR, administrée concomitamment avec le vaccin inactivé contre l’encéphalite japonaise, selon un schéma de prophylaxie pré-exposition (PrEP) rapide ou conventionnel, par voie intramusculaire. A partir du 57ème jour post-vaccination, une diminution plus rapide de la réponse immunitaire à la rage a été observée chez les personnes vaccinées en PrPE selon le schéma accéléré comparativement au schéma conventionnel lors de l’administration concomitante avec un vaccin inactivé contre l’encéphalite japonaise ou au schéma conventionnel de PrPE à la rage sans co-administration. A J366, les pourcentages de sujets ayant une concentration en ANVR ³0,5 UI/ml, étaient de respectivement 68%, 76% et 80% dans les groupes vaccinés contre la rage en schéma accéléré lors d’une co-administration avec un vaccin inactivé contre l’encéphalite japonaise, les groupes vaccinés contre la rage en schéma conventionnel lors d’une co-administration avec un vaccin inactivé contre l’encéphalite japonaise et dans le goupe vacciné contre la rage selon un schéma conventionnel sans co-administration.
Tous les sujets adultes présentaient une réponse immunitaire adéquate (ANVR ³0,5 UI/ml) 28 jours après une primo-vaccination comportant trois injections de RABIPUR administrées par voie intramusculaire selon le schéma conventionnel recommandé, lors de l’administration concomitante avec un vaccin méningococcique conjugué ACWY.
L'administration concomitante d'autres vaccins doit toujours avoir lieu dans des sites d'injection séparés, de préférence dans les membres opposés.
Fertilité
Aucune étude clinique de toxicité sur la reproduction et le développement n'a été réalisée.
Grossesse
Aucun effet préjudiciable attribuable à l'utilisation de Rabipur pendant la grossesse n’a été observé.
Lorsqu'une prophylaxie post-exposition est nécessaire, Rabipur peut être administré aux femmes enceintes.
Le vaccin peut également être utilisé à des fins de prophylaxie pré-exposition pendant la grossesse si les bénéfices attendus l’emportent sur les risques éventuels pour le fœtus.
Allaitement
Bien que l’excrétion de Rabipur dans le lait maternel ne soit pas connue, aucun risque n'a été identifié pour le nourrisson allaité. Rabipur peut être administré aux femmes qui allaitent lorsqu'une prophylaxie post-exposition est nécessaire.
Le vaccin peut également être utilisé à des fins de prophylaxie pré-exposition pendant l'allaitement si les bénéfices attendus l’emportent sur les risques éventuels pour le nourrisson.
Effets indésirables
1. Résumé des effets indésirables
1.1. Résumé du profil de sécurité
Des réactions anaphylactiques incluant les chocs anaphylactiques qui sont très rares mais cliniquement graves voire fatals et des réactions allergiques systémiques peuvent apparaître après une vaccination par Rabipur. Des réactions allergiques légères (telle qu’une hypersensibilité), incluant des éruptions cutanées (très fréquentes) et de l’urticaire (fréquent), peuvent survenir après la vaccination. Ces réactions sont généralement légères et disparaissent en quelques jours.
De très rares cas de sujets ayant des symptômes d’encéphalite et un syndrome de Guillain-Barré ont été rapportés après une vaccination par Rabipur.
Dans les essais cliniques, les effets indésirables sollicités les plus fréquemment rapportés étaient une douleur au site d’injection (30 – 85 %,) ou une induration au site d'injection (15 - 35%). La plupart des réactions au site d’injection n’étaient pas graves et ont disparu dans les 24 à 48 heures.
1.2. Résumé des effets indésirables
Les effets indésirables considérés comme les plus probablement liés à la vaccination ont été classés par fréquence.
Les fréquences sont définies comme ci-dessous :
- très fréquent : (≥1/10) ;
- fréquent : (≥1/100 to <1/10) ;
- peu fréquent : (≥1/1 000 to <1/100) ;
- rare : (≥1/10 000 to <1/1 000) ;
- très rare : (<1/10 000).
Dans chaque groupe de fréquence, les effets indésirables sont classés par ordre décroissant de gravité.
n plus des effets indésirables rapportés au cours des essais cliniques, des effets indésirables notifiées spontanément dans le monde depuis la commercialisation de RABIPUR ont été inclus dans la liste. Ces effets sont notifiés spontanément par une population de taille inconnue et ont été sélectionnés en raison de leur gravité, de leur fréquence de signalement, de la relation causale à RABIPUR ou d'une association de ces facteurs.
Liste des effets indésirables rapportés dans les essais cliniques et durant la surveillance après commercialisation :
Affections hématologiques et du système lymphatique
- Fréquent : lymphadénopathie.
Affections du système immunitaire
- Rare : hypersensibilité.
- Très rare : anaphylaxie dont choc anaphylactique *.
Troubles du métabolisme et de la nutrition
- Fréquent : perte d’appétit.
Affections du système nerveux
- Très fréquent : céphalées, sensation vertigineuse.
- Rare : paresthésie.
- Très rare : encéphalite *, syndrome de Guillain-Barré *, présyncope *, syncope *, vertiges *.
Affections gastro-intestinales
- Fréquent : nausées, vomissement, diarrhée, douleur/gêne abdominale.
Affections de la peau et du tissu sous-cutané
- Très fréquent : éruption cutanée.
- Fréquent : urticaire.
- Rare : hyperhidrose (sécrétion de sueur).
- Très rare : angiœdème *.
Affections musculo-squelettiques et du tissu conjonctif
- Fréquent : myalgies, arthralgies.
Troubles généraux et anomalies au site d’administration
- Très fréquent : réactions au site d’injection, malaise, fatigue, asthénie, fièvre.
- Rare : frissons
Population pédiatrique
Aucune différence n’est attendue pour la fréquence, le type et la sévérité des effets indésirables chez les enfants par rapport aux adultes.
2. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Certains des effets indésirables mentionnés à la rubrique 4.8 peuvent affecter la capacité à conduire des véhicules et à utiliser des machines.
3. Surdosage
Aucun symptôme de surdosage n'est connu.
4. Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Pharmacodynamie
Code ATC : J07BG01.
1. Mécanisme d’action
RABIPUR induit une stimulation des lymphocytes et des plasmocytes sécrétant des anticorps permettant la production d’ANVR.
2. Efficacité et sécurité cliniques
2.1. Prophylaxie de pré-exposition
Au cours d'essais cliniques chez les sujets n’ayant jamais été vaccinés la quasi-totalité des sujets présentait une réponse immunitaire adéquate (ANVR ≥ 0,5 UI/ml) 3 à 4 semaines après une primo-vaccination comportant trois injections de RABIPUR, administrées par voie intramusculaire selon le schéma recommandé.
Les essais cliniques ont montré une persistance de la réponse immunitaire adéquate (ANVR ≥ 0,5 UI/ml) jusqu’à 2 ans après la primo-vaccination par RABIPUR, sans dose de rappel. Comme la concentration d’anticorps diminue lentement, des doses de rappel peuvent être nécessaires pour maintenir un taux d’anticorps au-dessus de 0,5 UI/ml.
Le délai d’administration de rappels après une primo-vaccination selon le schéma accéléré ou après une administration concomitante n’a pas encore été établi. En raison d’une diminution plus rapide de la réponse immunitaire comparativement avec un schéma conventionnel, un intervalle plus court entre la primo-vaccination et l’administration du rappel peut être nécessaire (voir rubrique "Posologie").
Dans un essai clinique, il a été observé une augmentation de 10 fois voire plus, de la moyenne géométrique des concentrations (MGC) en anticorps 30 jours après une dose de rappel par RABIPUR administré 1 an après la première immunisation. Il a également été démontré que les sujets ayant été initialement immunisés par un vaccin rabique cultivé sur cellules diploïdes humaines (HDVC) présentaient une réaction anamnestique rapide après une injection de rappel avec RABIPUR.
2.2. Prophylaxie de post-exposition
Au cours d'essais cliniques, RABIPUR a induit des anticorps neutralisants (≥ 0,5 UI/ml) chez pratiquement tous les sujets à J14 et J30, après administration selon le protocole de « Essen » à 5 doses (jour 0, 3, 7, 14, 28 ; 1,0 ml chacune, en intramusculaire) ou le protocole de « Zagreb » à 4 doses (jour 0 [2 doses], 7, 21 ; 1,0 ml chacune, en intramusculaire). L'administration concomitante d'immunoglobulines antirabiques humaines et de la première dose de vaccin rabique a provoqué une légère baisse de la MGC (protocole de « Essen »). Toutefois, cette baisse n’a pas été considérée comme cliniquement significative.
Conservation
Durée de conservation : 48 mois.
A conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler.
Après reconstitution, le vaccin doit être utilisé immédiatement.
Conserver le flacon et l’ampoule dans l’emballage extérieur à l’abri de la lumière.
Le vaccin ne doit pas être utilisé après la date de péremption mentionnée sur l'emballage et le récipient.
Manipulation
Deux types de seringues préremplies, qui se distinguent par l’aspect de leur capuchon, sont disponibles.
Les deux types de seringues sont équipés d’un dispositif anti-retour qui facilite la manipulation et l’administration de l’injection. De plus, le dispositif anti-retour réduit le diamètre d’ouverture du corps de la seringue et permet dans le même temps de disposer d’une plus grande surface de butée avec des ailettes de forme ergonomique. Ce dispositif permet d’éviter que le piston ne soit extrait accidentellement de la seringue.
Avant de préparer l’administration de Rabipur, identifiez la seringue préremplie fournie dans votre boîte (avec capuchon scellé blanc ou avec capuchon à vis transparent) et suivez les instructions correspondant au type de seringue préremplie fourni.
Instructions d'utilisation de la seringue préremplie jetable de Rabipur
Seringue préremplie avec capuchon scellé blanc
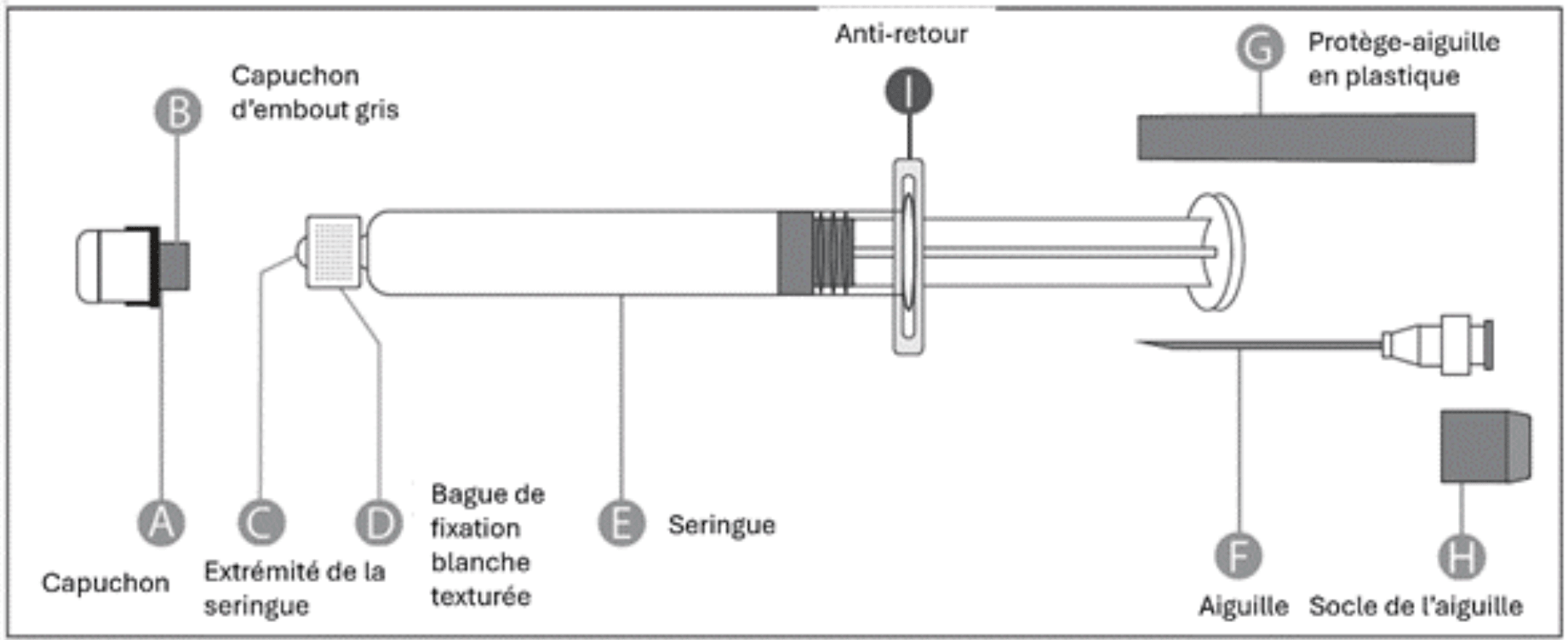 |
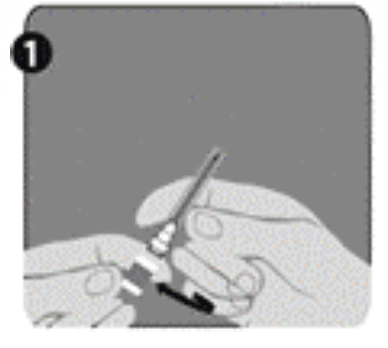
| Etape 1 : D'une main, tenez la seringue (E) avec le capuchon vers le haut. Veillez à tenir la seringue par la bague de fixation blanche texturée (D). |  |
| Etape 2 : De l'autre main, tenez le capuchon (A) et basculez-le fermement d'avant en arrière pour le détacher de la bague de fixation (D). Ne pas tordre et ne pas tourner le capuchon. | 
|
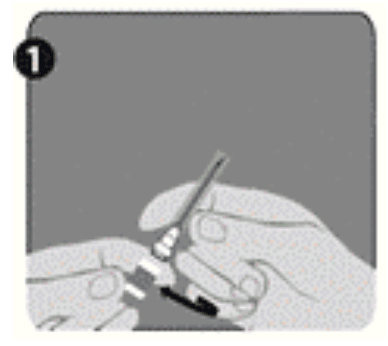
| Etape 3 : Soulevez le capuchon pour le retirer (A) ainsi que le capuchon d'embout gris attaché (B). Veillez à ne pas toucher l'extrémité stérile de la seringue (C). |  |
Fixation de l'aiguille (ces instructions s'appliquent aux deux aiguilles fournies) :
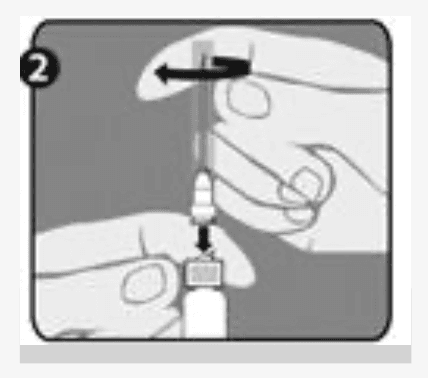
| Etape 1 : Tournez pour détacher le socle (H) de l'une des deux aiguilles identiques. Ce sera l’aiguille utilisée pour la reconstitution. Ne retirez pas le protège-aiguille en plastique (G). |
|
Etape 2 : D'une main, tenez fermement la seringue (E) par la bague de fixation blanche texturée (D). De l'autre main, insérez cette aiguille (F) et tournez-la dans le sens des aiguilles d'une montre jusqu'à ce qu'elle se verrouille en place. Une fois l'aiguille verrouillée, retirez le protège-aiguille en plastique (G). La seringue est alors prête à l'emploi.
|  |
Seringue préremplie avec capuchon à vis transparent
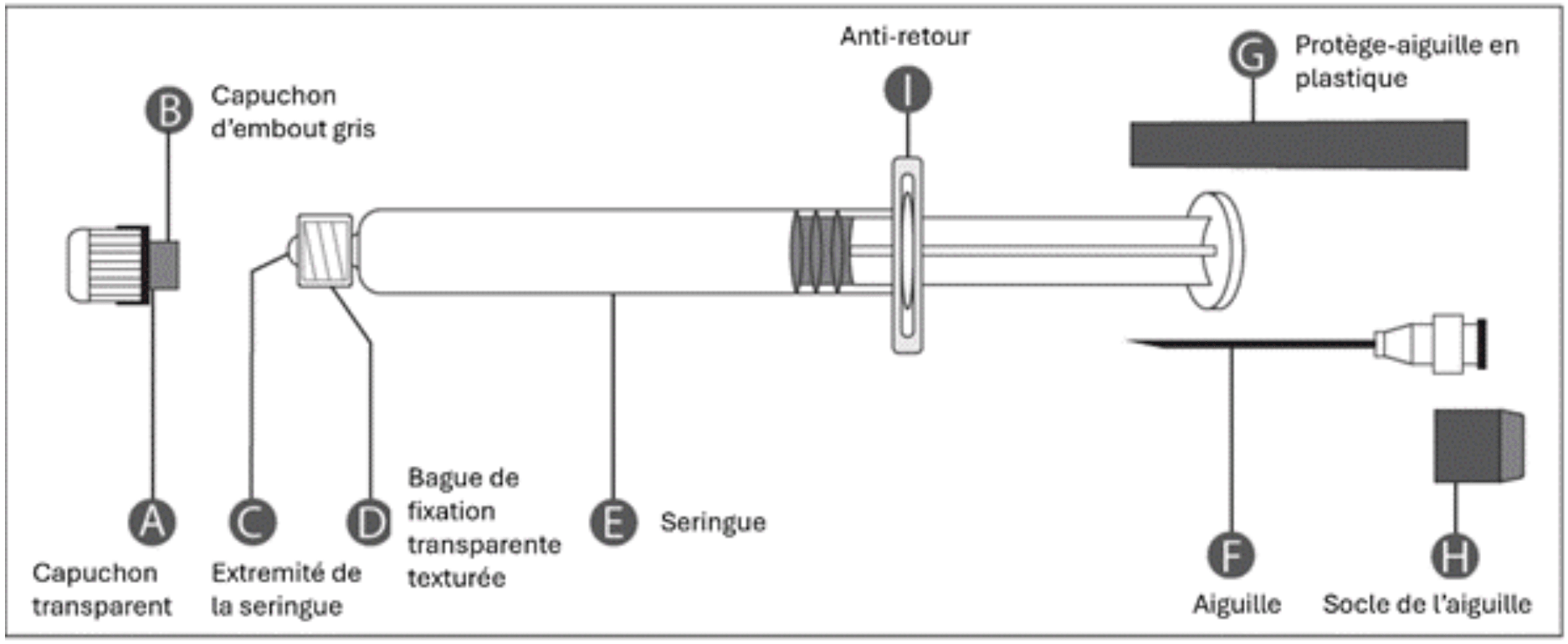 |
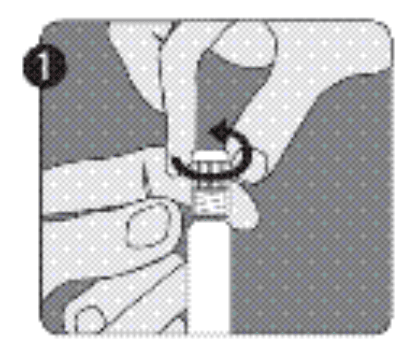
| Étape 1 : D'une main, tenez la seringue avec le capuchon vers le haut. Veillez à tenir la seringue par la bague de fixation transparente texturée (D). Dévissez le capuchon (A) en le faisant tourner dans le sens contraire des aiguilles d’une montre. |
|
Fixation de l'aiguille (ces instructions s'appliquent aux deux aiguilles fournies) :
| Étape 1 : Tournez pour détacher le socle (H) de l'une des deux aiguilles identiques. Ce sera l’aiguille utilisée pour la reconstitution. Ne retirez pas le protège-aiguille en plastique (G). |
|
Étape 2 : D'une main, tenez fermement la seringue par la bague de fixation transparente texturée (D). De l'autre main, insérez cette aiguille (F) et tournez-la dans le sens des aiguilles d'une montre jusqu'à sentir une légère résistance. Une fois l'aiguille verrouillée, retirez le protège-aiguille en plastique (G). La seringue est alors prête à l'emploi. |
|
Instructions de reconstitution de Rabipur avec la seringue préremplie
Le vaccin doit être inspecté visuellement avant et après la reconstitution afin de détecter la présence de particules et/ou un changement d'apparence physique. Le vaccin ne doit pas être utilisé en cas de changement de son aspect physique.
Le vaccin reconstitué est limpide à légèrement opalescent et incolore à légèrement rosé.
La poudre pour solution injectable doit être reconstituée à l'aide du solvant pour solution fourni et agitée avec précaution avant l'injection. Le vaccin reconstitué doit être utilisé immédiatement.
Pendant la fabrication, le flacon est scellé sous vide. Après reconstitution du vaccin, pour éviter les problèmes lors du prélèvement du vaccin reconstitué, il est recommandé de dévisser la seringue de l'aiguille afin d'éliminer la pression négative. Le vaccin peut alors être aisément prélevé du flacon. Il est déconseillé d'induire une pression excessive, car une surpression rendra difficile le prélèvement de la quantité appropriée de vaccin.
Après la reconstitution du vaccin, retirez le socle de l'aiguille d'injection orange (comme expliqué à l'étape 1 pour l'aiguille verte) et remplacez l'aiguille de reconstitution verte par l'aiguille d'injection orangeou une autre aiguille appropriée.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Note importante du fabricant
Suite à la présence de particules visibles dans le vaccin après reconstitution (caoutchouc transféré du bouchon des flacons de vaccin lors du processus de reconstitution, un phénomène connu sous le nom de « carottage »), le fabricant Bavarian Nordic recommande de suivre les étapes ci-dessous afin de minimiser ce risque :
- Ne pas utiliser et jeter la longue aiguille verte fournie avec le vaccin (calibre 21, 40 mm).
- Utilisez la petite aiguille d'injection orange (calibre 25, 25 mm) pour la reconstitution du vaccin.
- Comme la longueur de l'aiguille orange de calibre 25 n'atteindra pas le fond du flacon, veuillez retourner le flacon et tirer l'aiguille vers l’arrière près du bouchon, pour pouvoir prélever la totalité du vaccin reconstitué du flacon.
- Une fois le vaccin reconstitué prélevé dans la seringue, retirez l’aiguille orange de calibre 25 et utilisez une autre aiguille d’administration de calibre 25 pour injecter le vaccin.
En tout état de cause, le vaccin doit être soigneusement inspecté visuellement avant administration et ne doit pas être administré en cas de particules visibles.
Voir aussi : Remise à disposition du vaccin RABIPUR avec des recommandations concernant l'étape de reconstitution.
Autres informations
L'avis du Haut Conseil de la santé publique publié le 22 février 2013 actualise les recommandations relatives à la vaccination antirabique préventive, au traitement post-exposition et au suivi sérologique des personnes régulièrement exposées au virus de la rage (voyageurs, professionnels, chiroptérologues).
Données de sécurité préclinique
Les données précliniques,issues des études à dose unique, à doses répétées et des études de tolérance locale, n’ont révélé ni de résultat inattendu ni de toxicité pour les organes cibles. Aucune étude de génotoxicité, de carcinogénicité ou de toxicité pour la reproduction n’a été réalisée.
Remboursement
Prix libre, médicament non remboursable.
Cette présentation est agréée aux collectivités.