INFANRIX HEXA
Laboratoire : GSK Vaccines
Description
Vaccin pédiatrique diphtérique (anatoxine, dose standard), tétanique (anatoxine), coquelucheux (acellulaire multicomposé, dose standard, 3 composants), anti-Haemophilus influenzae type b (conjugué à l'anatoxine tétanique), poliomyélitique (entier inactivé, trivalent) et de l’hépatite B (recombinant), adsorbé.
Interchangeabilité
Forme et Présentation
Poudre et suspension pour suspension injectable.
Le composant diphtérique, tétanique, coquelucheux acellulaire, hépatite B, poliomyélitique inactivé (DTCa-HepB-P) se présente sous forme d'une suspension blanche trouble.
Le composant lyophilisé Haemophilus influenzae type b (Hib) est une poudre blanche.
Nature et contenu de l'emballage extérieur
- Poudre en flacon (verre de type I) contenant 1 dose muni d’un bouchon (caoutchouc butyle) et 0,5 mL de suspension en seringue préremplie (verre de type I) munie d’un bouchon-piston (caoutchouc butyle) et d’un embout protecteur en caoutchouc.
L’embout protecteur et le bouchon-piston en caoutchouc de la seringue préremplie ainsi que le bouchon du flacon sont fabriqués avec du caoutchouc synthétique.
Boîtes de 1 et de 10, avec ou sans aiguille(s) et un conditionnement multiple de 5 boîtes, contenant chacune 10 flacons et 10 seringues préremplies, sans aiguille.
Toutes les présentations peuvent ne pas être commercialisées.
Composition
Une dose (0,5 mL) contient après reconstitution :
1. Antigènes
- Anatoxine diphtérique 1 : ≥ 30 Unités Internationales (UI)
- Anatoxine tétanique 1 : ≥ 40 Unités Internationales (UI)
- Antigènes de Bordetella pertussis
- Anatoxine pertussique (PT) 1 : 25 µg
- Hémagglutinine filamenteuse (FHA) 1 : 25 µg
- Pertactine (PRN) 1 : 8 µg
- Antigène de surface du virus de l'hépatite B (HBs) 2,3 : 10 µg
- Virus poliomyélitiques (inactivés) (IPV)
- Type 1 (souche Mahoney) 4 : 40 unités antigène D
- Type 2 (souche MEF-1) 4 : 8 unités antigène D
- Type 3 (souche Saukett) 4 : 32 unités antigène D
- Polyoside d'Haemophilus type b (phosphate de polyribosylribitol, PRP) 3 : 10 µg
Conjugué à l'anatoxine tétanique en tant que protéine vectrice : environ 25 µg
2 Produit sur des cellules de levure (Saccharomyces cerevisiae) par la technologie de l'ADN recombinant ;
3 Adsorbé sur phosphate d'aluminium (AlPO4) : 0,32 mg Al3+ ;
4 Produit sur des cellules VERO.
2. Excipients
Poudre Hib :
- Lactose anhydre
Suspension DTCa-HeB-P :
- Chlorure de sodium (NaCl)
- Milieu 199 (comme stabilisateur contenant des acides aminés (dont la phénylalanine), des sels minéraux (dont le sodium et le potassium), des vitamines (dont l'acide para-aminobenzoïque) et d'autres substances)
- Eau pour préparation injectable
A l'état de traces
Ce vaccin peut contenir des traces de formaldéhyde, néomycine et polymyxine qui ont été utilisés au cours du processus de fabrication.
Excipients à effet notoire
Le vaccin contient 0,057 nanogramme d’acide para-aminobenzoïque par dose et 0,0298 microgramme de phénylalanine par dose (voir rubrique "Mises en garde et précautions d'emploi").
Indications
Infanrix hexa est indiqué pour la primovaccination et le rappel des nourrissons à partir de l’âge de 6 semaines et des enfants en bas âge contre la diphtérie, le tétanos, la coqueluche, l'hépatite B, la poliomyélite et les infections à Haemophilus influenzae type b.
Infanrix hexa doit être utilisé selon les recommendations officielles.
Posologie
Primovaccination
Le schéma de primovaccination comporte 2 ou 3 doses (de 0,5 mL) qui doivent être administrées selon les recommandations nationales officielles (voir tableau ci-dessous dans cette rubrique "Pharmacodynamie" pour les schémas évalués dans les études cliniques).
Le schéma recommandé dans le cadre du “programme élargi de vaccination” (à l'âge de 6, 10, 14 semaines) ne peut être utilisé que si une dose de vaccin contre l'hépatite B a été administrée à la naissance.
Lorsqu’une dose de vaccin contre l’hépatite B a été administrée à la naissance :
- Infanrix hexa peut être utilisé en remplacement de doses supplémentaires de vaccin contre l’hépatite B dès l’âge de six semaines. Si une seconde dose du vaccin contre l'hépatite B est nécessaire avant cet âge, un vaccin monovalent contre l'hépatite B doit être utilisé.
- Infanrix hexa peut être utilisé dans le cadre d'un schéma de primovaccination combinant le vaccin pentavalent et le vaccin hexavalent, conformément aux recommandations officielles.
Les recommandations nationales en vigueur pour la prophylaxie contre l'hépatite B doivent être maintenues.
Infanrix hexa peut être remplacé par l'administration d'un vaccin pentavalent coadministré avec le vaccin contre l'hépatite B.
Vaccination de rappel
Après une primovaccination à 2 ou 3 doses avec Infanrix hexa, une dose de rappel avec Infanrix hexa doit être administrée au moins 6 mois après la dernière dose de primovaccination (voir le tableau ci-dessous dans cette rubrique et la rubrique "Pharmacodynamie" pour les schémas évalués dans les essais cliniques). Infanrix hexa peut être utilisé comme vaccin de rappel chez les personnes qui ont déjà été vaccinées avec un autre vaccin hexavalent ou un vaccin pentavalent DTCa-P+Hib associé à un vaccin monovalent contre l'hépatite B lors de leur primovaccination.
Lorsqu'une dose de rappel avec un vaccin hexavalent contenant DTCa (diphtérie, tétanos et coqueluche acellulaire) n'est pas disponible, une dose de vaccin Hib doit être administrée, au minimum.
Population pédiatrique
La tolérance et l’efficacité d’Infanrix hexa chez les enfants de plus de 36 mois n’ont pas été établies. Aucune donnée n’est disponible.
1. Nourrissons nés à terme
1.1. Primovaccination en trois doses
- Vaccination de rappel : une dose de rappel doit être donnée.
- Un intervalle d’au moins 1 mois doit être respecté entre chaque dose de primovaccination.
- La dose de rappel doit être donnée au moins 6 mois après la dernière dose de primovaccination, et de préférence avant l’âge de 18 mois.
1.2. Primovaccination en deux doses
- Vaccination de rappel : une dose de rappel doit être donnée.
- Un intervalle d’au moins 2 mois doit être respecté entre chaque dose de primovaccination.
- La dose de rappel doit être donnée au moins 6 mois après la dernière dose de primovaccination, et de préference entre l’âge de 11 et 13 mois.
2. Nourrissons prematurés nés après une période de grossesse d’au moins 24 semaines
2.1. Primovaccination en trois doses
- Vaccination de rappel : une dose de rappel doit être donnée.
- Un intervalle d’au moins 1 mois doit être respecté entre chaque dose de primovaccination.
- La dose de rappel doit être donnée au moins 6 mois après la dernière dose de primovaccination, et de préference avant l’âge de 18 mois.
Mode d'administration
Infanrix hexa doit être injecté par voie intramusculaire profonde, de préférence en des sites distincts à chaque injection.
Pour les instructions de reconstitution du médicament avant administration, voir rubrique "Manipulation".
Contre-indications
Hypersensibilité à l’une des substances actives ou à l’un des excipients listés en rubrique composition (Autres substances), ou au formaldéhyde, à la néomycine et à la polymyxine.
Hypersensibilité suite à une précédente administration d’un vaccin diphtérique, tétanique, coquelucheux, de l’hépatite B, poliomyélitique ou de l’Haemophilus influenzae de type b
Infanrix hexa est contre-indiqué chez les nourrissons et les enfants en bas âge ayant présenté une encéphalopathie d'étiologie inconnue, survenue dans les 7 jours suivant une vaccination antérieure par un vaccin contenant la valence coquelucheuse. Dans ce cas, la vaccination anticoquelucheuse doit être suspendue et la vaccination doit être poursuivie avec des vaccins diphtérique, tétanique, de l'hépatite B, poliomyélitique et Hib.
Comme pour les autres vaccins, l'administration d'Infanrix hexa doit être différée chez les sujets atteints d'infections fébriles sévères aiguës. La présence d'une infection bénigne n'est pas une contre indication.
Mises en garde et précautions d'emploi
La vaccination doit être précédée d'une recherche des antécédents médicaux (notamment pour les vaccinations antérieures et les événements indésirables ayant pu survenir) et d'un examen clinique.
Comme pour tous les vaccins, une réponse immunitaire protectrice peut ne pas être obtenue chez tous les sujets vaccinés (voir rubrique "Pharmacodynamie").
Infanrix hexa ne protège pas contre des agents pathogènes autres que Corynebacterium diphteriae, Clostridium tetani, Bordetella pertussis, le virus de l’hépatite B, le poliovirus ou l’Haemophilus influenzae type b. Cependant, ce vaccin pourrait protéger aussi contre l’infection liée au virus de l’hépatite D (causé par l’agent delta) puisque celle-ci ne survient pas en l’absence d’une infection par l’hépatite B.
Si la survenue de l'un des événements suivants est chronologiquement liée à l'administration d'un vaccin contenant la valence coquelucheuse, la décision d'administrer d'autres doses de vaccins contenant la valence coquelucheuse doit être soigneusement évaluée :
- fièvre ≥ 40,0 °C, dans les 48 heures, sans autre cause identifiable ;
- collapsus ou état de choc (épisode d'hypotonie-hyporéactivité) dans les 48 heures après la vaccination ;
- cris persistants, inconsolables pendant une durée ≥ 3 heures, survenant dans les 48 heures après la vaccination ;
- convulsions, avec ou sans fièvre, survenant dans les 3 jours après la vaccination.
Il peut exister certaines circonstances, notamment en cas d'incidence élevée de coqueluche, où les bénéfices potentiels de la vaccination dépassent les risques éventuels.
Comme avec tous les vaccins injectables, il est recommandé de toujours disposer d'un traitement médical approprié et d'assurer une surveillance pour le cas rare où surviendrait une réaction anaphylactique suivant l'administration du vaccin.
Comme pour toute vaccination, le rapport bénéfice-risque de réaliser une vaccination par Infanrix hexa ou de la reporter, chez un nourrisson ou un enfant souffrant d'une maladie neurologique sévère qu'elle soit nouvelle ou évolutive, doit être évalué avec attention.
Infanrix hexa doit être administré avec précaution chez les sujets présentant une thrombocytopénie ou un trouble de la coagulation en raison du risque de saignement qui peut survenir lors de l'administration intramusculaire du vaccin chez ces sujets.
Ne pas administrer le vaccin par voie intravasculaire ou intradermique.
Des antécédents de convulsions fébriles, des antécédents familiaux de convulsions ou de syndrome de mort subite du nourrisson ne sont pas des contre-indications à l’utilisation d’Infanrix hexa. Les sujets vaccinés ayant des antécédents de convulsions fébriles doivent être surveillés avec attention en raison de la survenue possible de ce type d’évènements indésirables dans les 2 à 3 jours suivant la vaccination.
Lors de l'administration concomitante d’Infanrix hexa et d’un vaccin pneumococcique conjugué (PCV7, PCV10, PCV13) ou d’un vaccin rougeole-oreillons-rubéole-varicelle (RORV), le médecin doit tenir compte du fait que le taux de réactions fébriles est supérieur à celui observé lors de l'administration d'Infanrix hexa seul. Ces réactions étaient le plus souvent modérées (fièvre inférieure ou égale à 39 °C) et transitoires (voir rubriques "Interaction" et "Effets indésirables").
Lors de l’administration concomitante d’Infanrix hexa et de Prevenar 13, une augmentation des taux de déclarations de convulsions (avec ou sans fièvre) et d’épisodes d’hypotonie-hyporéactivité (EHH) a été observée (voir rubrique "Effets indésirables").
L’administration prophylactique d’antipyrétiques avant ou immédiatement après l’administration du vaccin peut réduire l’incidence et l’intensité de réactions fébriles post-vaccinales. Les données cliniques générées avec le paracétamol et l’ibuprofène suggèrent que l’utilisation prophylactique du paracétamol pourrait réduire l’incidence des réactions fébriles, alors que l’utilisation prophylactique d’ibuprofène a montré un effet limité dans la réduction de l’incidence des réactions fébriles. L’utilisation en prophylaxie de traitements antipyrétiques est recommandée pour les enfants ayant des troubles convulsifs ou des antécédents de convulsions fébriles.
Un traitement antipyrétique devrait être instauré selon les recommandations nationales.
Populations particulières
L'infection par le VIH n'est pas considérée comme une contre-indication. La réponse immunitaire attendue risque de ne pas être obtenue après vaccination chez les patients immunodéprimés.
Les données cliniques indiquent qu’Infanrix hexa peut être administré aux nourrissons prématurés, cependant, comme attendu dans cette population, une réponse immunitaire plus faible à certains antigènes a été observée (voir rubriques "Effets indésirables" et "Pharmacodynamie").
Le risque potentiel d'apnée avec nécessité de surveillance respiratoire pendant 48 à 72 heures doit être soigneusement pris en compte lors de l'administration des doses de primovaccination chez les grands prématurés (nés à 28 semaines de grossesse ou moins), et particulièrement chez ceux ayant des antécédents d'immaturité respiratoire.
En raison du bénéfice élevé de la vaccination chez ces nourrissons, l'administration ne doit pas être suspendue ou reportée.
Interférence avec les analyses biologiques
Du fait de l’élimination urinaire de l’antigène polyosidique capsulaire Hib, un résultat positif peut être observé lors d’un test urinaire 1 à 2 semaines après la vaccination. D’autres tests doivent être effectués pour confirmer une infection Hib pendant cette période.
Excipients à effet notoire
Infanrix hexa contient de l'acide para-aminobenzoïque. Il peut provoquer des réactions allergiques (éventuellement retardées), et exceptionnellement, des bronchospasmes.
Mise à jour du 11/05/2022. Ce vaccin contient 0,0298 microgramme de phénylalanine dans chaque dose. La phénylalanine peut être dangereuse pour les personnes atteintes de phénylcétonurie (PCU), une maladie génétique rare caractérisée par l’accumulation de phénylalanine ne pouvant être éliminée correctement.
Ce vaccin contient moins de 1 mmol (23 mg) de sodium par dose, c'est-à-dire qu’il est essentiellement « sans sodium ».
Ce vaccin contient moins de 1 mmol (39 mg) de potassium par dose, c'est-à-dire qu’il est essentiellement « sans potassium ».
Traçabilité
Afin d’améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Interactions
Infanrix hexa peut être administré de façon concomitante à un vaccin pneumococcique conjugué (PCV7, PCV10 et PCV13), un vaccin méningococcique conjugué du sérogroupe C (conjugué à la protéine CRM197 et à l’anatoxine tétanique), un vaccin méningococcique conjugué des sérogroupes A, C, W et Y (conjugué à l’anatoxine tétanique), un vaccin méningococcique du sérogroupe B (MenB), un vaccin oral contre les infections à rotavirus et le vaccin rougeole-oreillons-rubéole-varicelle (RORV).
Les données n’ont montré aucune interférence cliniquement significative sur la réponse en anticorps pour chacun des antigènes, bien qu’une réponse variable en anticorps au poliovirus inactivé de type 2 ait été observée lors de l’administration concomitante avec Synflorix (séroprotection variant de 78 % à 100 %) et que les taux de réponse immunitaire à l‘antigène PRP (Hib) d‘Infanrix hexa après 2 doses administrées à l‘âge de 2 et 4 mois étaient plus élevés lors de l‘administration concomitante avec un vaccin pneumococcique conjugué à l‘anatoxine tétanique ou avec un vaccin méningococcique (voir rubrique "Pharmacodynamie"). La pertinence clinique de ces observations restent à établir.
Lors de l’administration concomitante d’Infanrix hexa avec des vaccins MenB et pneumococciques conjugués, les études ont montré des résultats contradictoires concernant les réponses au poliovirus inactivé de type 2, à l’antigène conjugué pneumococcique de sérotype 6B et à l’antigène pertactine de la coqueluche mais ces données ne suggèrent pas d’interférence cliniquement significative.
Lors de l'administration concomitante d’Infanrix hexa avec des vaccins pneumococciques conjugués, les données cliniques montrent un taux de réactions fébriles supérieur à celui observé lors de l'administration d'Infanrix hexa seul. Lors de l'administration concomitante d’Infanrix hexa et d’un vaccin RORV, les données d’une étude clinique montrent un taux de réactions fébriles supérieur à celui observé lors de l'administration d'Infanrix hexa seul et similaire à celui observé lors de l’administration du vaccin RORV seul (voir rubriques "Mises en garde et précautions d’emploi" et "Effets indésirables"). Les réponses immunitaires n’étaient pas modifiées.
En raison d’une augmentation du risque de fièvre, de douleur au site d’injection, de perte d’appétit et d’irritabilité lorsqu’Infanrix hexa est co-administré avec un vaccin MenB et un vaccin conjugué pneumococcique à 7 valences, des vaccinations séparées peuvent être envisagées lorsque cela est possible.
Comme avec les autres vaccins, l'immunogénicité peut être diminuée chez les patients traités par des immunosuppresseurs.
Grossesse
Infanrix hexa n'étant pas destiné à l'adulte, les données concernant l'utilisation du vaccin chez la femme durant la grossesse et les études de reproduction chez l'animal ne sont pas disponibles.
Allaitement
Infanrix hexa n'étant pas destiné à l'adulte, les données concernant l'utilisation du vaccin chez la femme allaitante ne sont pas disponibles.
Effets indésirables
1. Résumé du profil de tolérance
Comme cela a été observé avec les vaccins DTCa et les vaccins combinés contenant les valences DTCa, une augmentation de la réactogénicité locale et de la fièvre a été rapportée après rappel avec Infanrix hexa par rapport à la primovaccination.
1.1. Résumé des effets indésirables
Au sein de chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Les fréquences par dose sont définies comme suit :
- très fréquent : ≥ 1/10 ;
- fréquent : ≥ 1/100 et < 1/10 ;
- peu fréquent : ≥ 1/1000 et < 1/100 ;
- rare : ≥ 1/10 000 et < 1/1000 ;
- très rare : < 1/10 000.
Les effets indésirables suivants liés au médicament ont été rapportés dans les études cliniques (données provenant de plus de 16 000 sujets) et au cours de la surveillance post-commercialisation.
Effets indésirables
Infection et infestations
- Peu fréquent : infection des voies respiratoires supérieures.
Affections hématologiques et du système lymphatique
- Rare : lymphadénopathie 2, thrombocytopénie 2.
Affections du système immunitaire
- Rare : réactions anaphylactiques 2, réactions anaphylactoïdes (incluant urticaire) 2, Réactions allergiques (incluant prurit) 2.
Troubles du métabolisme et de la nutrition
- Très fréquent : perte d’appétit.
Affections psychiatriques
- Très fréquent : cris inhabituels, irritabilité, agitation.
- Fréquent : nervosité.
Affections du système nerveux
- Très fréquent : somnolence.
- Rare : collapsus ou état de choc (épisode d'hypotonie-hyporéactivité) 2.
- Très rare : convulsions (avec ou sans fièvre).
Affections respiratoires, thoraciques et médiastinales
- Peu fréquent : toux.
- Rare : bronchite, apnée 2[voir rubrique "Mises en garde et précautions d'emploi" pour l’apnée chez les grands prématurés (nés à 28 semaines de grossesse ou moins)].
Affections gastro-intestinales
- Fréquent : diarrhée, vomissements.
Affections de la peau et du tissu sous- cutané
- Rare : éruption cutanée, angioedème 2.
- Très rare : dermatite.
Troubles généraux et anomalies au site d’administration
- Très fréquent : fièvre ≥ 38 °C, douleur, rougeur, gonflement localisé au site d’injection (≤ 50 mm).
- Fréquent : fièvre > 39,5 °C, réactions au site d’injection, incluant induration, gonflement localisé au site d’injection (> 50 mm) 1.
- Peu fréquent : gonflement diffus du membre vacciné, se propageant parfois à l’articulation adjacente 1, fatigue.
- Rare : gonflement du membre vacciné dans sa totalité 1,2, réactions de gonflement étendu 2, nodule au site d’injection 2, vésicules au site d’injection 2.
2 Effets indésirables issus de notifications spontanées.
1.2. Expérience relative à la co-administration
L'analyse des taux de déclarations depuis la commercialisation suggère un risque potentiel accru de convulsions (avec ou sans fièvre) et d'EHH en cas d'administration concomitante d'Infanrix hexa et de Prevenar 13 par rapport à l'administration d'Infanrix hexa seul.
Au cours des études cliniques où des sujets vaccinés ont reçu Infanrix hexa et Prevenar (PCV7) de façon concomitante, comme doses de rappel (4èmedose), une fièvre ≥38,0 °C a été rapportée chez 43,4 % des nourrissons ayant reçu Prevenar et Infanrix hexa simultanément comparée à 30,5 % des nourrissons ayant reçu le vaccin hexavalent seul. Une fièvre ≥39,5 °C a été observée respectivement chez 2,6 % et 1,5 % des nourrissons recevant Infanrix hexa avec ou sans Prevenar (voir rubriques "Mises en garde et précautions d’emploi" et "Interactions"). L’incidence et la sévérité de la fièvre suite à l’administration concomitante de ces 2 vaccins en primovaccination était inférieure à celle observée après rappel.
Les données cliniques montrent que l’incidence de la fièvre est comparable lors de l’administration concomitante d’Infanrix hexa avec un autre vaccin pneumococcique polyosidique conjugué.
Lors d’une étude clinique au cours de laquelle des sujets vaccinés ont reçu de façon concomitante une dose de rappel d’Infanrix hexa avec un vaccin rougeole-oreillons-rubéole-varicelle (RORV), une fièvre ≥ 38.0 °C a été rapportée chez 76,6 % des enfants ayant reçu simultanément le vaccin RORV et Infanrix hexa, comparativement à 48 % des enfants recevant Infanrix hexa seul et 74,7 % des enfants recevant le vaccin RORV seul. Une fièvre supérieure à 39.5 °C a été rapportée chez 18 % des enfants recevant Infanrix hexa avec le vaccin RORV, comparativement à 3,3 % des enfants recevant Infanrix hexa seul et 19,3 % des enfants recevant le vaccin RORV seul (voir rubriques "Mises en garde et précautions d’emploi" et "Interactions").
1.3. Tolérance chez les nourrissons prématurés
Infanrix hexa a été administré chez plus de 1000 nourrissons prématurés (nés après une période de grossesse de 24 à 36 semaines) au cours d’études de primovaccination et chez plus de 200 nourrissons prématurés en rappel dans la deuxième année de vie. Dans les études cliniques comparatives, des fréquences similaires de symptômes ont été observées entre les nourrissons prématurés et les nourrissons nés à terme (voir rubrique "Mises en garde et précautions d’emploi" pour une information sur l’apnée).
1.4. Tolérance chez les nourrissons et les enfants nés de mères vaccinées avec dTca pendant la grossesse
Dans deux études cliniques, Infanrix hexa a été administré à plus de 500 sujets nés de mères vaccinées avec dTca (n=341) ou avec un placebo (n=346) pendant le troisième trimestre de grossesse (voir rubrique "Pharmacodynamie"). Le profil de sécurité d’Infanrix hexa était similaire indépendamment de l’exposition/non-exposition au dTca pendant la grossesse.
1.5. Données concernant le vaccin contre l'hépatite B
Dans des cas extrêmement rares, les effets suivants ont été rapportés : réactions allergiques à type de maladie sérique, paralysie, neuropathie, névrite, hypotension, vascularite, lichen plan, érythème polymorphe, arthrite, faiblesse musculaire, syndrome de Guillain-Barré, encéphalopathie, encéphalite et méningite. Le lien de causalité avec le vaccin n'a pas été établi.
2. Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Sans objet.
3. Surdosage
Aucun cas de surdosage n'a été rapporté.
4. Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Pharmacodynamie
Classe pharmacothérapeutique : Vaccins combinés viraux et bactériens.
Code ATC : J07CA09
1. Immunogénicité
L’immunogénicité d’Infanrix hexa a été évaluée dans des études cliniques à partir de l’âge de 6 semaines. Le vaccin a été évalué selon des schémas de primovaccination en 2 et 3 doses, intégrant le schéma recommandé dans le cadre du “programme élargi de vaccination”, et en dose de rappel. Les résultats de ces études cliniques sont résumés dans les tableaux ci-après.
Après un schéma de primovaccination en 3 doses, au moins 95,7 % des nourrissons ont développé des taux d’anticorps séroprotecteurs ou séropositifs contre chacun des antigènes vaccinaux. Après la vaccination de rappel (après la 4ème dose), au moins 98,4 % des enfants ont développé des taux d’anticorps séroprotecteurs ou séropositifs contre chacun des antigènes vaccinaux.
Pourcentage de sujets avec des titres en anticorps indicateurs d'une séroprotection/séropositivité un mois après une primovaccination en 3 doses et une vaccination de rappel avec Infanrix hexa
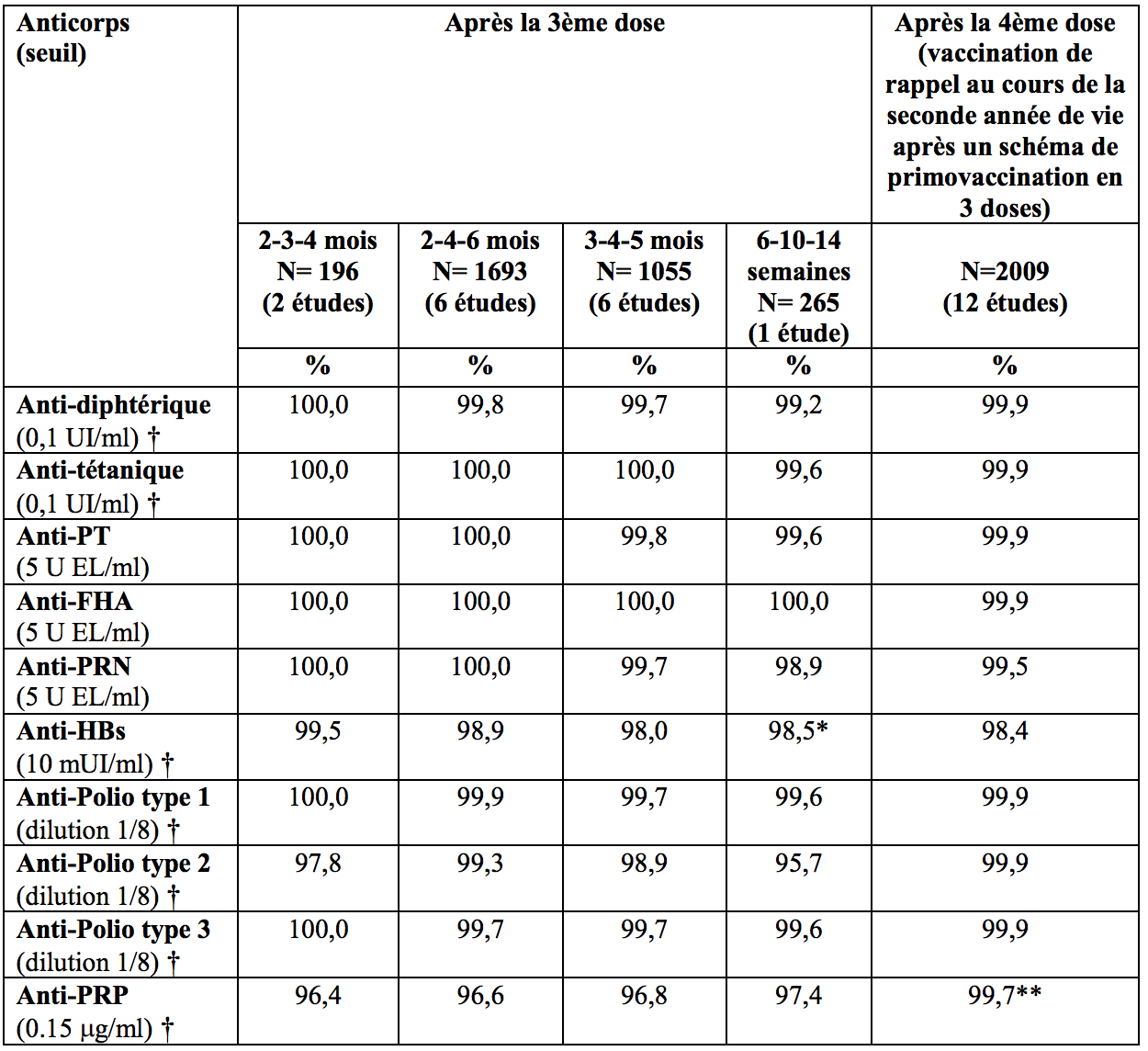

* Dans un sous-groupe de nourrissons n’ayant pas reçu le vaccin hépatite B à la naissance, 77,7 % des sujets avaient un titre en anticorps anti-HBs ≥10 mUI/mL ;
** Après rappel, 98,4 % des sujets avaient une concentration en anticorps anti-PRP ≥1 μg/mL, indicateur d’une protection à long terme ;
† Seuil considéré comme indicateur de protection.
Après un schéma de primovaccination en 2 doses, au moins 84,3 % des nourrissons avaient développé des taux d’anticorps séroprotecteurs ou séropositifs contre chacun des antigènes vaccinaux. Après une vaccination complète avec Infanrix hexa selon un schéma de primovaccination en 2 doses et une dose de rappel, au moins 97,9 % des sujets ont développé des taux d’anticorps séroprotecteurs ou séropositifs contre chacun des antigènes vaccinaux.
Selon différentes études, la réponse immunitaire à l'antigène PRP d'Infanrix hexa après l’administration de 2 doses à l’âge de 2 et 4 mois varie en cas d’administration concomitante avec un vaccin conjugué à l'anatoxine tétanique. Infanrix hexa confère une réponse immunitaire anti-PRP (seuil ≥0,15μg / mL) chez au moins 84 % des nourrissons. Ce chiffre atteint 88 % en cas d’administration concomitante avec un vaccin pneumococcique contenant de l'anatoxine tétanique en tant que vecteur et à 98 % lors d’une administration concomitante d’Infanrix hexa avec un vaccin méningococcique conjugué à l'anatoxine tétanique (voir rubrique "Interactions").
Pourcentage de sujets avec des titres en anticorps indicateurs d’une séroprotection/séropositivité un mois après une primovaccination en 2 doses et une vaccination de rappel avec Infanrix hexa
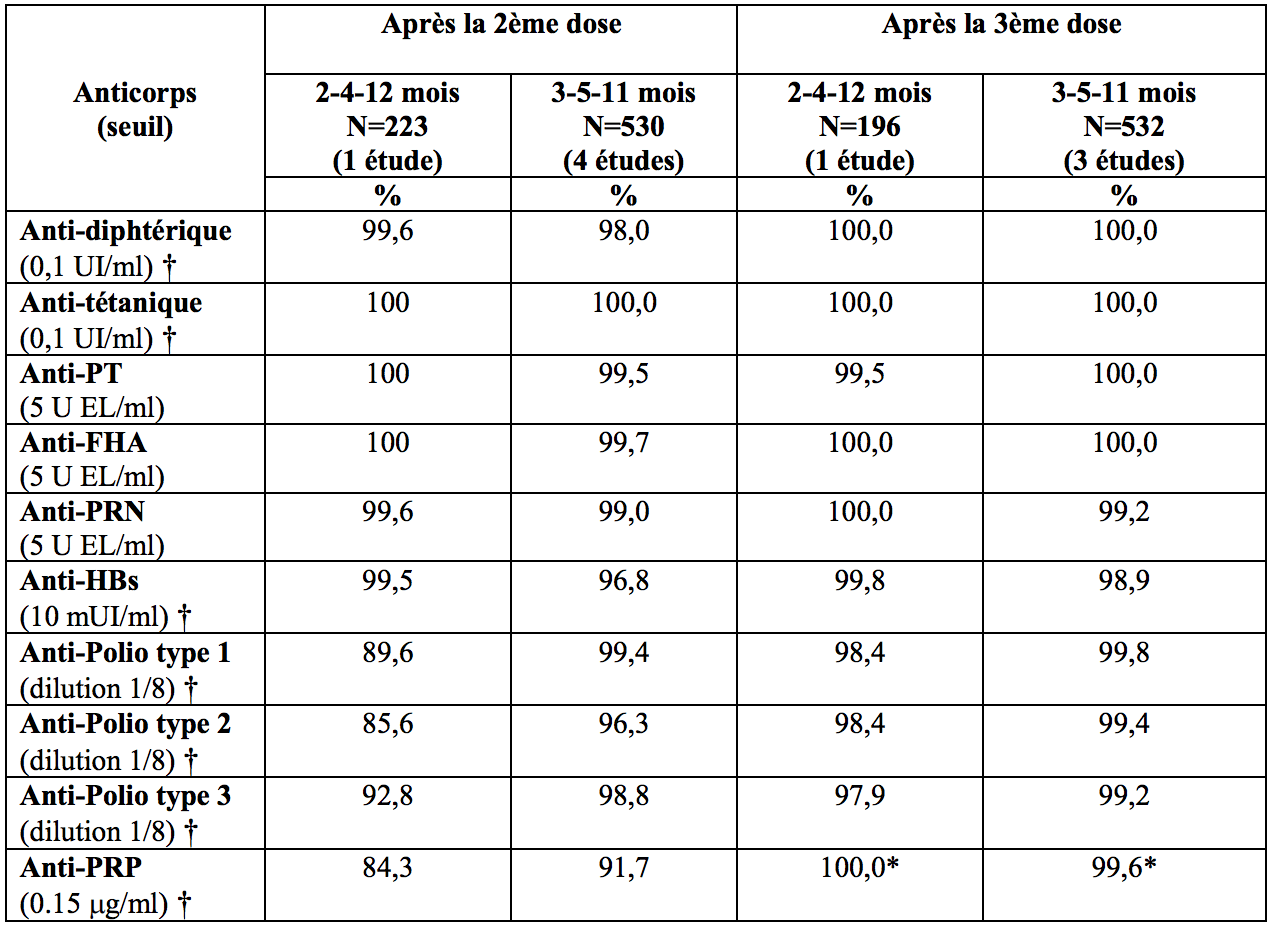

† Seuil considéré comme indicateur de protection ;
* Après rappel, 94,4 % des sujets ayant reçu un schéma 2-4-12 mois et 97,0 % des sujets ayant reçu un schéma 3-5-11 mois avaient une concentration en anticorps anti-PRP ≥ 1 μg/mL, indicateur d’une protection à long terme.
Des corrélats sérologiques de protection ont été établis pour la diphtérie, le tétanos, la polio, l’hépatite B et le Hib. Pour la coqueluche, il n’y a pas de corrélat sérologique de protection. Cependant, la réponse immunitaire aux antigènes coquelucheux suite à l’administration d’Infanrix hexa étant équivalente à celle d’Infanrix (DTCa), il est attendu que l’efficacité protectrice des deux vaccins soit équivalente.
2. Efficacité protectrice contre la coqueluche
L'efficacité protectrice du composant coquelucheux d’Infanrix (DTCa) telle que définie selon les critères de l’OMS (≥ 21 jours de toux paroxystique) a été démontrée après primovaccination en 3 doses dans les études tabulées ci-dessous :
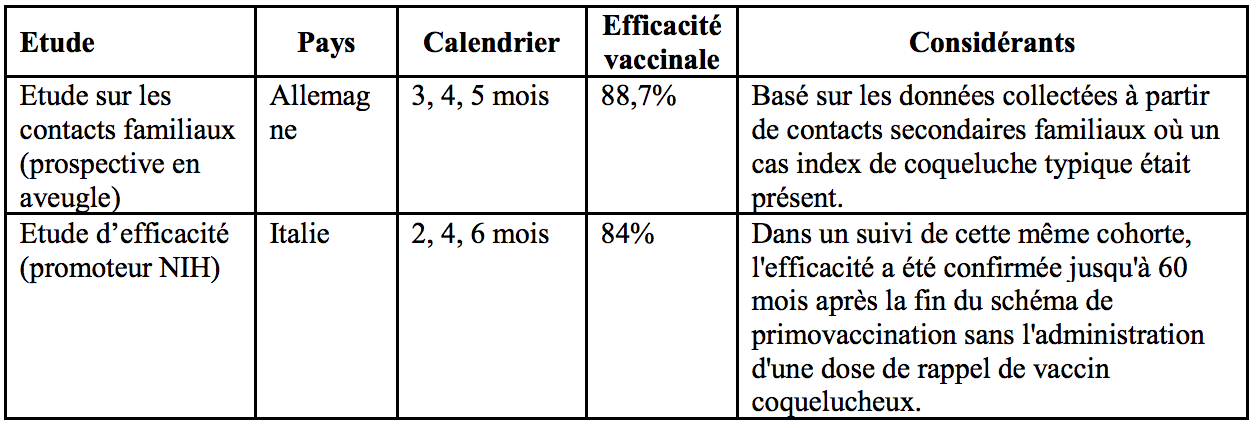

3. Persistance de la réponse immunitaire
La persistance de la réponse immunitaire après un schéma de primovaccination en 3 doses (à l’âge de 2-3-4, 3-4-5 ou 2-4-6 mois) et une dose de rappel (au cours de la deuxième année de vie) avec Infanrix hexa a été évaluée chez des enfants âgés de 4 à 8 ans. Une immunité protectrice contre les 3 types de poliovirus et le PRP a été observée chez au moins 91,0 % des enfants et contre la diphtérie et le tétanos chez au moins 64,7 % des enfants. Au moins 25,4 % (anti-PT), 97,5 % (anti-FHA) et 87,0 % (anti-PRN) des enfants étaient séropositifs contre les composants coquelucheux.
Pourcentage de sujets avec des titres en anticorps indicateurs d’une séroprotection / séropositivité après primovaccination et vaccination de rappel avec Infanrix hexa
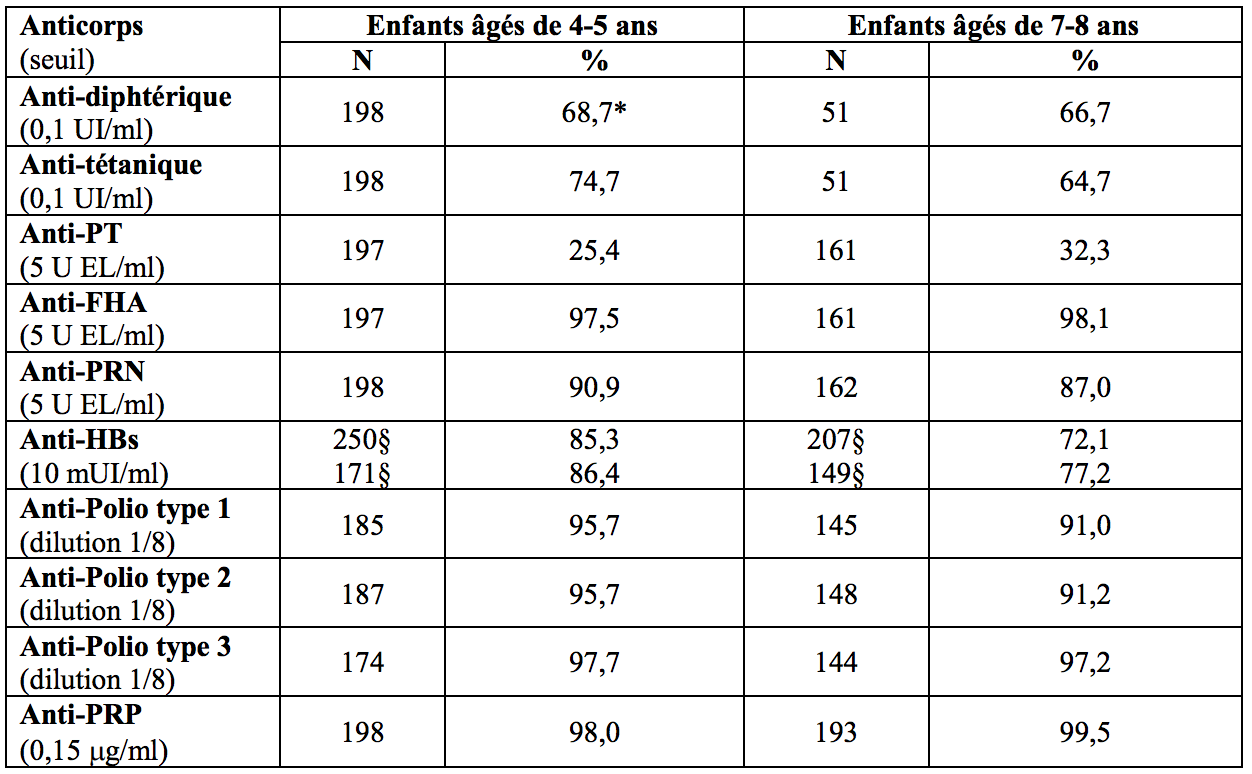

* Les échantillons analysés par ELISA avec des concentrations en anticorps anti-diphtérie < 0,1 UI/mL ont été analysés à nouveau avec le test de neutralisation de cellules Vero (seuil de séroprotection ≥0,016 UI/ml) : 96,5 % des sujets étaient séroprotégés ;
§ Nombre de sujets provenant de 2 études cliniques.
Concernant l’hépatite B, l’immunité protectrice (≥10 mUI/mL) après un schéma de primovaccinationen 3 doses et une dose de rappel avec Infanrix hexa ont été maintenues chez ≥ 85 % des sujets âgés de 4 à 5 ans et chez ≥ 72 % des sujets âgés de 7 à 8 ans et chez ≥ 60 % des sujets âgés de 12 à 13 ans. Par ailleurs, après une primovaccination en 2 doses et une dose de rappel, des concentrations en anticorps séroprotecteurs contre l’hépatite B ont été maintenues chez ≥ 48% des sujets âgés de 11 à 12 ans.
La mémoire immunologique contre l’hépatite B a été confirmée chez les enfants âgés de 4 à 15 ans. Ces enfants avaient reçu dans l’enfance Infanrix hexa en primovaccination et en rappel, et lorsqu’une dose supplémentaire de vaccin monovalent HBV était administrée, une immunité protectrice a été observée chez au moins 93 % des sujets.
4. Immunogénicité chez les nourrissons et les enfants nés de mères vaccinées avec le dTca pendant la grossesse
L'immunogénicité d'Infanrix hexa chez les nourrissons et les enfants nés de mères en bonne santé vaccinées avec le dTca à 27-36 semaines de grossesse a été évaluée dans deux études cliniques. Infanrix hexa a été co-administré avec un vaccin pneumococcique conjugué 13-valent aux nourrissons à 2, 4 et 6 mois ou à 2, 3 et 4 mois dans le cadre du schema de primovaccination en trois doses(n=241), ou à 3 et 5 mois ou à 2 et 4 mois dans le cadre du schéma de primovaccination en deux doses (n=27) ; et aux mêmes nourrissons/enfants de 11 à 18 mois en dose de rappel (n=229).
Après la primovaccination et la vaccination de rappel, les données immunologiques n'ont pas montré d'interférence cliniquement pertinente de la vaccination maternelle avec le dTca sur les réponses du nourrisson et du jeune enfant à la diphtérie, au tétanos, à l'hépatite B, au poliovirus inactivé, à l’Haemophilus influenzae type b ou aux antigènes pneumococciques.
Des concentrations d'anticorps plus faibles contre les antigènes de la coqueluche, après la primovaccination (PT, FHA et PRN) et la vaccination de rappel (PT, FHA), ont été observées chez les nourrissons et les jeunes enfants nés de mères vaccinées avec le dTca pendant la grossesse. L'augmentation des concentrations d'anticorps anticoquelucheux avant le rappel et un mois après le rappel était similaire pour les nourrissons et les jeunes enfants nés de mères vaccinées avec le dTca ou avec un placebo, ce qui démontre une primovaccination efficace du système immunitaire. En l'absence de corrélats de protection contre la coqueluche, la pertinence clinique de ces observations reste à comprendre. Cependant, les données épidémiologiques actuelles sur la coqueluche, suite à la mise en place de l'immunisation maternelle par le dTca, ne suggèrent pas de pertinence clinique de cette interférence immunitaire.
5. Immunogénicité chez les prématurés
L’immunogénicité d’Infanrix hexa a été évaluée au cours de trois études incluant environ 300 prématurés (nés après une période de grossesse de 24 à 36 semaines) suite à un schéma de primovaccination en 3 doses à 2, 4 et 6 mois. L’immunogénicité d’une dose de rappel administrée entre 18 et 24 mois a été évaluée chez environ 200 prématurés.
Un mois après une primovaccination, au moins 98,7 % des sujets étaient séroprotégés contre la diphtérie, le tétanos et les poliovirus de type 1 et 2 ; au moins 90,9 % avaient des taux d’anticorps séroprotecteurs dirigés contre les antigènes hépatite B, PRP et poliovirus de type 3 ; et tous les sujets étaient séropositifs pour les anticorps anti-FHA et anti-PRN tandis que 94,9 % étaient séropositifs pour les anticorps anti-PT.
Un mois après la dose de rappel, au moins 98,4 % des sujets présentaient des taux d’anticorps séroprotecteurs ou séropositifs dirigés contre chacun des antigènes vaccinaux, excepté contre PT (au moins 96,8 %) et hépatite B (au moins 88,7 %). L’augmentation des concentrations en anticorps (de 15 à 235 fois) après la dose de rappel indique que les prématurés étaient correctement primovaccinés pour l’ensemble des antigènes d’Infanrix hexa.
Dans une étude de suivi menée chez 74 enfants, environ 2,5 à 3 ans après la dose de rappel, 85,3 % des enfants étaient toujours séroprotégés contre l’hépatite B et au moins 95,7 % étaient séroprotégés contre les trois types de poliovirus et PRP.
6. Expérience post-commercialisation
Les résultats de suivi à long terme en Suède démontrent que les vaccins coquelucheux acellulaires sont efficaces chez les nourrissons, lorsqu’ils sont administrés selon le schéma de primovaccination à 3 et 5 mois, avec une dose de rappel à l’âge de 12 mois environ. Cependant, les données indiquent que la protection contre la coqueluche pourrait diminuer à l’âge de 7-8 ans avec ce schéma 3-5-12 mois. Ceci suggère qu’une seconde dose de rappel de vaccin coquelucheux est justifiée chez les enfants âgés de 5 à 7 ans préalablement vaccinés avec ce schéma particulier.
L'efficacité sur le terrain du composé Hib de Infanrix hexa a été étudiée dans le cadre d’une large étude de surveillance post-commercialisation menée en Allemagne. Après un suivi de 7 ans l’efficacité sur le terrain de la valence Hib de deux vaccins hexavalents, dont l’un était Infanrix hexa, a été de 89,6 % pour un schéma de primovaccination complet et de 100 % pour un schéma complet de primovaccination et une dose de rappel (quel que soit le vaccin Hib utilisé pour la primovaccination).
Les résultats de la surveillance nationale de routine en cours en Italie démontrent qu’Infanrix hexa est efficace sur le contrôle des infections à Hib chez les nourrissons lorsque le vaccin est administré selon le schéma de primovaccination à 3 et 5 mois, avec une dose de rappel à 11 mois environ. Sur une période de 6 ans débutant en 2006, pendant laquelle Infanrix hexa était le principal vaccin utilisé contenant la valence Hib avec une couverture vaccinale excédant 95 %, les infections invasives à Hib ont continué à être bien contrôlées, avec quatre cas confirmés d’infection à Hib rapportés dans le cadre de la surveillance passive chez des enfants italiens âgés de moins de 5 ans.
Conservation
Durée de conservation : 4 ans.
Après reconstitution, une utilisation immédiate est recommandée. Cependant, la stabilité a été démontrée pendant 8 heures à + 21 °C après reconstitution.
Précautions particulières de conservation
A conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler.
A conserver dans l’emballage extérieur d'origine à l'abri de la lumière.
Les données de stabilité montrent que les composants du vaccin sont stables à une température allant jusqu'à 25 °C pendant une durée de 72 heures. A l'issue de cette période, Infanrix hexa doit être utilisé ou jeté. Ces données sont destinées uniquement à orienter les professionnels de santé dans le cas d'une excursion temporaire de température.
Pour les conditions de conservation après reconstitution du médicament, voir rubrique "Manipulation".
Manipulation
Durant la conservation, un liquide clair et un dépôt blanc peuvent être observés dans la seringue préremplie contenant la suspension DTCa-HepB-P. Cette observation est normale.
La seringue préremplie doit être bien agitée afin d'obtenir une suspension trouble blanche homogène.
Le vaccin est reconstitué en ajoutant la totalité du contenu de la seringue préremplie au flacon contenant la poudre. Avant l’administration, le mélange doit être bien agité jusqu’à ce que la poudre soit complètement dissoute.
Le vaccin reconstitué apparaît comme une suspension légèrement plus trouble que le composant liquide seul. Cette observation est normale.
La suspension vaccinale doit être inspectée visuellement, avant et après reconstitution, pour mettre en évidence la présence de toute particule étrangère et/ou une altération de l’aspect physique. Si l’un ou l’autre de ces cas est observé, ne pas administrer le vaccin.
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
Instructions d’utilisation de la seringue préremplie
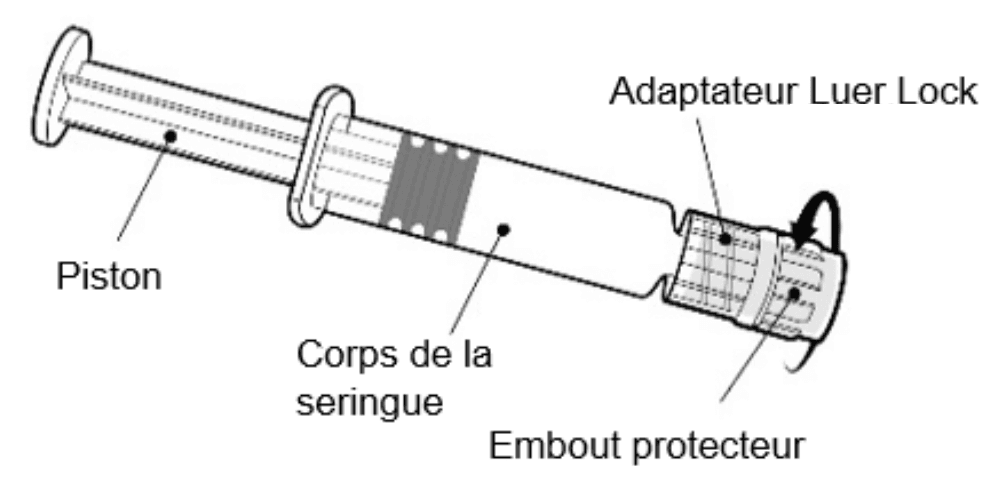 |
|
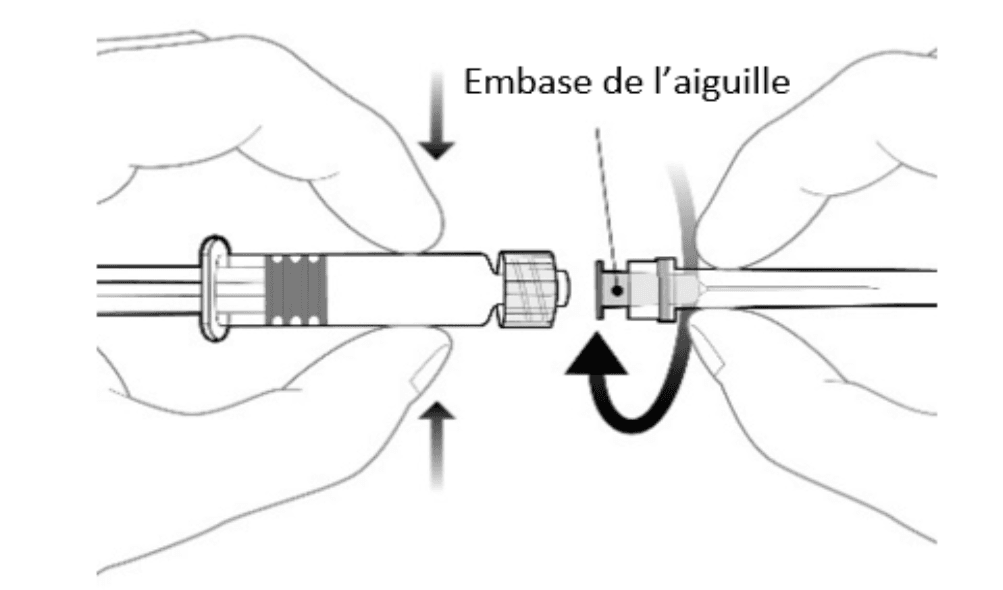 |
|
L'administration du vaccin doit être consignée par le médecin sur le carnet de vaccination ou de santé avec le numéro de lot. Il peut aussi être inscrit par le patient ou son médecin sur un carnet de vaccination numérique (version grand public ou professionnelle).
Instructions d’élimination
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Autres informations
Données de sécurité précliniques
Les données non cliniques basées sur des études conventionnelles de sécurité, toxicologie spécifique, toxicologie par administration réitérée et compatibilité des composants n’ont pas révélé de risque particulier pour l'homme.
Remboursement
Remboursé par la Sécurité sociale à 65 %.
Cette présentation est agréée aux collectivités.